
科目: 来源: 题型:
【题目】现有钠、镁、铁质量分别为2.3 g、2.4 g、5.6 g,使其分别与100 mL 0.5 mol/L的盐酸充分反应后,所得H2的质量关系正确的是( )
A.氢气的质量相同
B.铁放出氢气最多
C.钠放出氢气最多,铁最少
D.钠放出的氢气最多,镁铁相同
查看答案和解析>>
科目: 来源: 题型:
【题目】将4mol A气体和2mol B气体置于1L的密闭容器中,混合后发生如下反应:2A(g)+B(g)=2C(g)+D(s)。若经2s后测得C的浓度为1.8mol/L,下列说法正确的是
A.2s时物质A的浓度为0.9mol/L
B.用物质D表示的反应速率为0.45mol/(L·s)
C.用物质A表示的反应速率为1.8mol/(L·s)
D.2s时物质B的浓度为1.1mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,甲同学将电极放入6 mol·L-1 H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
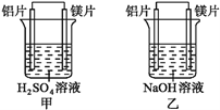
请回答:
(1写出甲池中正极的电极反应式:______________________;负极的电极反应式:______________________。
(2乙池中负极是_______;正极是_______。
(3)由此实验,可得到如下哪些正确结论?_______(填写字母序号)。
a.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
b.镁的金属性不一定比铝的金属性强
c.该实验说明金属活动性顺序已过时,已没有实用价值
d.该实验说明化学研究对象复杂,反应受条件影响较大,应具体问题具体分析
查看答案和解析>>
科目: 来源: 题型:
【题目】现有反应:mA(g)+B(g)2C(g),达到平衡后,当升高温度时,A的转化率变小;当减小压强时,混合体系中C的质量分数不变,则:
(1)该反应的△H__________0(填“>”或“<”),且m________1(填“>”“=”“<”).
(2)若加入B(假设容器的体积不变),则A的转化率__________,B的转化
率__________. (填“增大”“减小”或“不变”)
(3)若B是有色物质,A、C均无色,则加入C(假设容器的体积不变)时混合物颜色__________,而维持容器内压强不变,充入氖气时,混合物颜色__________(填“变深”“变浅”或“不变”).
(4)一定温度下,向1L密闭容器中加入1mol C(g)使其分解,气体A的物质的量随时间的变化如图所示.则0~2分钟内的平均反应速率υ(C)=_________.
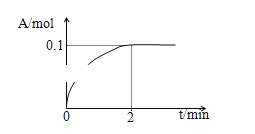
查看答案和解析>>
科目: 来源: 题型:
【题目】已知醋酸、盐酸和碳酸钠是生活中常见的物质。
(1)碳酸钠水溶液显碱性的原因是(用离子方程式表示)______________________________
(2)25 ℃时,浓度均为0.1mol/L的盐酸和醋酸溶液,下列说法正确的是_________________;
①两溶液的pH相同
②两溶液的导电能力相同
③由水电离出的c(OH-)相同
④中和等物质的量的NaOH溶液,消耗两溶液的体积相同
(3)25 ℃时,有pH 均等于4的醋酸溶液和氯化铵溶液,醋酸中水电离出的H+浓度与氯化铵溶液中水电离出的H+浓度之比是________________
(4)25 ℃时,向体积为Va mLpH=3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与的Vb关系是Va__________Vb(填“>”、“<”或“=”)。
(5)醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,下列叙述不正确的是_____
CH3COO-+H+,下列叙述不正确的是_____
a.CH3COOH溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO)
b.0.1 mol / L 的CH3COOH 溶液加水稀释,溶液中c(OHˉ)减小
c.CH3COOH溶液中加入少量CH3COONa固体.平衡逆向移动
d.常温下,pH=2的CH3COOH溶液与pH=12的NaOH 溶液等体积混合后溶液的pH <7
e.室温下向pH=3的醋酸溶液中加水稀释,溶液中![]() 不变
不变
查看答案和解析>>
科目: 来源: 题型:
【题目】电解硫酸钠溶液生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1∶2,以下说法正确的是( )

A. a极与电源的负极相连
B. a电极反应式:2H2O+2e-= H2↑+2OH-
C. 离子交换膜d为阴离子交换膜
D. 产物丙为硫酸溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】在100 mL H2SO4和CuSO4的混合液中,用石墨作电极进行电解,两极上均收集到2.24 L气体(标准状况下),则原混合液中Cu2+的物质的量浓度为( )
A. 1 mol·L-1 B. 2 mol·L-1 C. 3 mol·L-1 D. 4 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】香菇是含烟酸较高的食物,烟酸分子中六元环的结构与苯环相似。下列有关烟酸的说法错误的是

A. 所有的碳原子均处同一平面
B. 与硝基苯互为同分异构体
C. 六元环上的一氯代物有5种
D. 1mol烟酸能和3mol氢气发生加成反应
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)室温下,以惰性电极电解100 mL 0.1mol/LNaCl溶液,写出电解总反应的化学方程式______________________________________;若阴阳两极均得到112 mL气体(标准状况),则所得溶液的pH为_________(忽略反应前后溶液的体积变化)。
(2)某学生用中和滴定法测定某NaOH溶液的物质的量浓度,选酚酞作指示剂。盛装0.2000 mol/L盐酸标准液应该用________式滴定管;用盐酸滴定待测液NaOH,滴定终点时的颜色变化是____________________且30s不变色;滴定前用待测液润洗锥形瓶,则所测NaOH溶液的浓度___________(填“无影响”、“偏高”或“偏低”下同);若滴定前平视读数,滴定终点时俯视读数,则会使所测NaOH溶液的浓度值___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物A由周期不同的短周期元素X、Y组成,是良好的耐热冲击材料。
(1)X的单质既可与盐酸反应,又可与NaOH溶液反应,X的原子结构示意图为________。
(2)X的硫酸盐溶液与过量NaOH溶液反应的离子方程式为__________________________________。
(3)一定条件下,A和水缓慢作用生成含Y的化合物B,B分子是四核的10电子分子。A的化学式是________。B与H2O2反应,其产物之一是Y的单质,Y的单质的电子式为________;B分子的结构式________。
(4)X的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到两种产物均由两种元素组成,且都是新型陶瓷材料,其反应的化学方程式是______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com