
科目: 来源: 题型:
【题目】有关物质的量的计算:
(1)2 mol尿素[CO(NH2)2]含__个H原子,所含氧原子跟_____g H2O所含氧原子个数相等。
(2)2.4g 镁中含______mol电子,在与足量盐酸反应中产生标准状况下的氢气体积为 ______L。
(3)30.9gNaR含有Na+ 0.3mol,则NaR的摩尔质量为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示。请回答:

(1)若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Zn,A极材料为铜,该装置能量转换形式____, A为____极,此电池所发生的反应化学方程式为_____,反应进行一段时间后溶液C中c(H+)将_____(填“变大” “变小”或“基本不变”)。溶液中的SO42-移向____极(填“A”或“B”)
(2)若C为CuSO4溶液,B电极材料为Fe,A极材料为石墨。则B为_____极,B极上电极反应属于____(填“氧化反应”或“还原反应”)。B电极上发生的电极反应式为______,A极产生的现象是_____;若AB两电极质量都为50.0g且反应过程中有0.2mol的电子发生转移,理论上AB两电极质量差为____g。
查看答案和解析>>
科目: 来源: 题型:
【题目】近日,我国科研团队研发出一种蓝藻人造叶片系统,其核心是一种可以向细胞外分泌蔗糖的蓝藻,其工作原理如图。下列说法不正确的是

A. 该系统利用了蓝藻的光合作用
B. 理论上,系统出水量小于进水量
C. 可用银氨溶液检验产物中是否含蔗糖
D. 该系统有望为人类探索太空时解决生存难题提供新思路
查看答案和解析>>
科目: 来源: 题型:
【题目】下列六种短周期元素(用字母x等表示)。最高正价或最低负价与原子序数关系如图所示。

根据判断出的元素回答问题:
(1)f在周期表中的位置是______。已知x为非金属元素,由x、e、g三种元素组成的离子化合物的电子式:______。
(2)上述元素简单离子半径最大的是(用化学式表示,下同):___;比较g、h的最高价氧化物对应水化物的酸性强弱:_____。
(3)已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5 kJ热量,写出该反应的热化学方程式:__________。
(4)x和d组成的化合物中,既含有极性共价键又含有非极性共价键的是____(填化学式),此化合物可将碱性工业废水中的CN-氧化,生成碳酸盐和氨气,相应的离子方程式为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将等物质的量的氢气和碘蒸气放入密闭容器中进行反应:H2(g)+I2(g)![]() 2HI(g)(正反应放热),反应经过5分钟测得碘化氢的浓度为0.5mol/L,碘蒸气的浓度为0.25mol/L。请填写以下空白:
2HI(g)(正反应放热),反应经过5分钟测得碘化氢的浓度为0.5mol/L,碘蒸气的浓度为0.25mol/L。请填写以下空白:
(1)v(HI)=__;v(H2)=__;H2的起始浓度=__。
(2)若上述反应达到平衡时,则平衡浓度c(HI)、c(I2)、c(H2)的关系是__(填“相等”、“2∶1∶1”或“均为恒量”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组同学进行如下实验,以检验化学反应中的能量变化。
(1)实验中发现,反应后①中的温度升高;②中的温度降低。由此判断铝条与盐酸的反应是__热反应,Ba(OH)28H2O与NH4Cl反应时,需要将固体研细其目的是_。反应过程__(填“①”或“②”)的能量变化可用图表示。

(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的是_(填序号)。
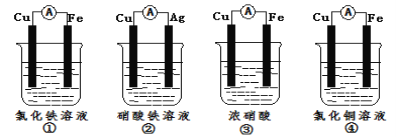
(3)将CH4设计成燃料电池,其利用率更高,装置如图所示(a、b为多孔碳棒)其中_(填A或B)处电极入口通甲烷,当消耗标况下甲烷33.6L时,假设能量转化率为90%,则导线中转移电子的物质的量为__mol。

(4)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:

①当电极c为Al、电极d为Cu、电解质溶液为稀硫酸时,写出该原电池正极的电极反应式为__。
②当电极c为Al、电极d为Mg、电解质溶液为氢氧化钠溶液时,该原电池的负极反应式为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组以亚硝酸钠(NaNO2)溶液为研究对象,探究NO2-的性质。
实验 | 试剂 | 编号及现象 | |
滴管 | 试管 | ||
2mL | 1%酚酞溶液 | 1 mol·L-1 NaNO2溶液 | 实验I:溶液变为浅红色,微热后红色加深 |
1 mol·L-1 NaNO2溶液 | 0.1 mol·L-1 KMnO4 溶液 | 实验II:开始无明显变化,向溶液中滴加稀硫酸后紫色褪去 | |
KSCN溶液 | 1 mol·L-1 FeSO4 溶液(pH=3) | 实验III:无明显变化 | |
1 mol·L-1 NaNO2溶液 | 1 mol·L-1 FeSO4 溶液(pH=3) | 实验IV:溶液先变黄,后迅速变为棕色,滴加KSCN溶液变红 | |
资料:[Fe(NO)]2+在溶液中呈棕色。
(1)结合化学用语解释实验I“微热后红色加深”的原因 ______
(2)实验II证明NO2-具有_____性, 从原子结构角度分析原因_________
(3)探究实验IV中的棕色溶液
①为确定棕色物质是NO与Fe2+,而非Fe3+发生络合反应的产物,设计如下实验,请补齐实验方案。
实验 | 溶液a | 编号及现象 |
| 1 mol·L-1FeSO4溶液(pH=3) | i.溶液由___色迅速变为___色 |
____________________ | ii.无明显变化 |
②加热实验IV中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释上述现象产生的原因_________。
(4)络合反应导致反应物浓度下降,干扰实验IV中氧化还原反应发生及产物检验。小组同学设计实验V:将K闭合后电流表指针发生偏转,向左侧滴加醋酸后偏转幅度增大。
①盐桥的作用是____________________________
②电池总反应式为______________________
实验结论:NO2-在一定条件下体现氧化性或还原性,氧还性强弱与溶液酸碱性等因素有关。

查看答案和解析>>
科目: 来源: 题型:
【题目】常温下在20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入40 mL浓度为0.1 mol·L-1的盐酸,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。下列说法正确的是

A. 在混合溶液中,H2CO3、HCO3-、CO32-能大量共存
B. 当pH=7时,溶液中离子浓度的大小关系为c(Na+)>c(Cl-)>c(HCO3-)>c(H+)>c(CO32-)>c(OH-)
C. 已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh![]() =2.0×10-4,当溶液中(HCO3-):(CO32-)= 2:1时,溶液的pH=10
=2.0×10-4,当溶液中(HCO3-):(CO32-)= 2:1时,溶液的pH=10
D. Kh不受温度的影响,升高温度,溶液中各种离子浓度不变
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式_____________________________________________。
(2)Na2A的水溶液呈______性 ,原因是(用离子方程式表示):____________________,往Na2A溶液中加入___________可抑制其水解
A .NaOH固体 B.氯化铁固体 C.水 D.碳酸钠固体
已知Ksp(BaA)=1.8×10-10,往20mL 1 mol·L-1Na2A溶液中加入10 mL 1 mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为______ mol·L-1。(忽略A2—的水解)
(3)若溶液M由2 mol·L-1H2A溶液与4mol·L-1NaOH溶液等体积混合而得,若所得溶液M的pH>7,则溶液中离子浓度由大到小顺序为_____________。
(4)若溶液M由下列三种情况:①0.01 mol·L-1的H2A溶液;②0.01 mol·L-1的NaHA溶液;③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为________;pH由大到小的顺序为____________________________________________。
(5)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为:_____________________(填“V1>V2”“ V1<V2”“ V1=V2”或“均有可能”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学小组制备氢氧化铁胶体:洁净的小烧杯盛适量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入1 mol·L-1氯化铁溶液,至液体呈透明的红褐色。回答下列问题:
(1)氢氧化铁胶体中微粒直径的范围是________________。
(2)检验胶体制备成功的操作是__________________________________。
(3)实验中手不慎被玻璃割破,可用氯化铁溶液应急止血,主要原因是____________(填序号)。
①氯化铁溶液具有杀菌消毒的作用
②氯化铁溶液能使血液胶体凝固
③氯化铁溶液能产生氢氧化铁沉淀堵住伤口
④氯化铁溶液能使血液发生化学变化
(4)制备胶体的化学方程式为_______。如果将1molFeCl3全部制成胶体,胶粒数目______NA(选填“大于”“等于”“小于”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com