
科目: 来源: 题型:
【题目】一定条件下,某容器中各微粒在反应前后变化的示意图如下,其中●和○代表不同元素的原子。

关于此反应的说法不正确的是
A. 反应物总能量一定低于生成物总能量 B. 一定属于可逆反应
C. 一定有非极性共价键断裂 D. 一定属于氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示装置中观察到电流计指针偏转,M棒变粗、N棒变细,以此判断下表中所列M、N、P物质,其中可以成立的是

选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】计算填空:
(1)______mol CO2中含有氧原子数跟1.806×1024个H2O分子含有的氧原子数相同。
(2)3.01×1023个H2O所含电子的物质的量为________mol。
(3)某同学将标准状况下44.8L的HCl气体溶于水,配成500mL的溶液,该HCl气体的物质的量为______,可知所配成的盐酸溶液的物质的量浓度为_____。
(4)标准状况下的甲烷和一氧化碳的混合气体8.96 L,其质量为7.60 g,则混合气体中甲烷的体积为______;一氧化碳的质量为_________。
(5)气态化合物A的化学式可以表示为OxFy,已知同温同压下10mLA受热完全分解生成15mLO2和10mL F2,则A的化学式为_____。
(6)将5 mol·L-1的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO![]() 的物质的量浓度是______ mol·L-1。
的物质的量浓度是______ mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原
反应的关系”可用如图表达。

试写出有水参加的符合反应类型Ⅳ的一个化学方程式:_____________________________,其中水为________剂。
(2)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:___CuO+____NH4Cl ![]() ____Cu+____CuCl2+____N2↑+____H2O。
____Cu+____CuCl2+____N2↑+____H2O。
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是______(填元素名称),氧化剂是________(填化学式)。
③反应中若产生0.2mol的气体,则有________mol的电子转移。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁触媒是重要的催化剂,铁触媒在500 ℃左右时的活性最大,这也是合成氨反应一般选择在500 ℃左右进行的重要原因之一。CO易与铁触媒作用导致其失去催化活性:Fe+5CO===Fe(CO)5;在溶液中除去CO的化学方程式为[Cu(NH3)2]OOCCH3+CO+NH3 = 刹[Cu(NH3)3(CO)]OOCCH3。请回答下列问题:
(1)基态Fe原子的核外电子排布式为[Ar]___;C、N、O的电负性由大到小的顺序为______。
(2)Cu2+在水中呈现蓝色是因为形成了四水合铜(Ⅱ)离子,其化学式为______;配合物[Cu(NH3)2]OOCCH3中,铜显___价,碳原子的杂化轨道类型是______,NH3价电子对互斥理论模型是______。
(3)用[Cu(NH3)2]OOCCH3溶液除去CO的反应中,肯定有________(填字母)形成。
A.离子键 B.配位键 C.非极性键 D.σ键
(4)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是________。
(5)单质铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为________,面心立方堆积与体心立方堆积的两种铁晶体的密度之比为________(写出已化简的比例式即可)。(两种堆积中最邻近的铁原子的核间距相等)

查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组同学设计如图装置:


回答下列问题:
(1)乙中铜片为________极 (填“正”或“负”),其电极反应式为________。
(2)一段时间后,将甲和乙两池溶液混合,加入H2O2和一定量稀硫酸后,有Fe(OH)3沉淀出现,但没有Cu(OH)2沉淀出现,此时溶液中c(Fe3+)=2.6×10-18 mol·L-1,求溶液中Cu2+的最大物质的量浓度________。(已知2Fe2++H2O2+2H+=2Fe3++2H2O,Ksp(Fe(OH)3)=2.6×10-39,Ksp(Cu(OH)2)=2.2×10-20)。
(3)丙中电源的A极为________极(填“正”或“负”)。
(4)若丙池盛放足量的CuSO4溶液:
①在丙池铁棒这极的现象是________。
②在丙池中阳极的电极反应是________。
(5)若丙池中盛放滴加少量酚酞的足量的饱和NaCl溶液1L(假设溶液体积电解前后无变化)。
①丙池通电一段时间后,________极附近溶液呈红色(填Fe或C),总反应的离子方程式:________。
②25℃时,当丙池中有0.1mol电子发生转移时切断电源,则理论上标准状况下共有________ L气体生成。此时溶液的pH为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
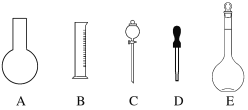
(1)①如图所示的仪器中配制溶液肯定不需要的是____________________(填字母),
②配制上述溶液还需用到的玻璃仪器是__________________(填仪器名称)。
③下列有关容量瓶使用说法不正确的是( )
a.容量瓶使用前一定要检查是否漏液。其操作为装水盖上瓶塞→倒立观察是否漏夜→正立→玻璃塞旋转180°→再倒立观察是否漏夜。
b.不能作为反应容器或长期贮存溶液的容器;但是可以配制任意体积的溶液。
c.不能将固体或浓溶液直接在容量瓶中溶解或稀释;不能加入过冷或过热的液体 。
d.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小。
(2)在配制NaOH溶液时:
①根据计算用托盘天平称取NaOH的质量为________g;
②若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度___________(填“>”、“<”或“=”)0.1 mol·L-1;
③若NaOH固体溶解后立即移入容量瓶→洗涤烧杯和玻璃棒→洗涤液移入容量瓶→定容,则所得溶液浓度___________(填“>”、“<”或“=”) 0.1 mol·L-1。
(3)在配制硫酸溶液时:
①所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为__________(计算结果保留一位小数)mL;
②如果实验室有15 mL、50 mL、100 mL量筒,应选用___________mL量筒最好;
③配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知t ℃时,0.01 mol/L NaOH溶液的pH=11,0.1 mol/L的HA溶液中c(H+)/c(OH-)=109
请回答下列问题:
(1)该温度下,水的离子积Kw=_____,0.1 mol/L的HA溶液中水电离出的c(OH-)=_____。
(2)在室温下,将pH之和为14的NaOH溶液和HA溶液等体积混合后,所得溶液呈_____(填“酸”“碱”或“中”)性。
(3)在室温下,蒸馏水稀释0.01 mol/L HA溶液时,下列呈减小趋势的是_____。
A.水的电离程度 B.c(HA)/c(A-)
C.溶液中c(H+)和c(OH-)的乘积 D.溶液中c(A-)·c(HA)的值
(4)室温下,取pH=2的盐酸和HA溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示:

①图中表示HA溶液pH变化曲线的是____(填“A”或“B”)。
②设盐酸中加入Zn的质量为m1,HA溶液中加入Zn的质量为m2,则m1_____m2(填“>”“<”或“=”)。
(5)室温下,取0.01 mol/L的盐酸和HA溶液各100 mL,分别滴加0.01 mol/LNaOH溶液至恰好完全反应,所需NaOH溶液的体积前者____后者(填“>”“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】设 NA 为阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,16 g O2 和 O3 的混合物所含的电子数为 8NA
B.标准状况下,2.24 L 水中所含的电子数为 NA
C.0.1 mol Na2O2 晶体中所含的离子数为 0.4NA
D.1 mol Fe 在氧气中充分燃烧失去的电子数为 3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,800 ℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是

A. 发生的反应可表示为2A(g)![]() 2B(g)+C(g)
2B(g)+C(g)
B. 前2 min A的分解速率为0.1 mol/(L·min)
C. 开始时,正、逆反应同时开始
D. 2 min时,A、B、C的浓度之比为2∶3∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com