
科目: 来源: 题型:
【题目】ⅡBⅥA族半导体纳米材料(如CdTe、CdSe、ZnSe、ZnS等)在光电子器件、太阳能电池以及生物探针等方面有广阔的前景。回答下列问题:
(1)基态锌(Zn)原子的电子排布式为[Ar]_____。
(2)“各能级最多容纳的电子数,是该能级原子轨道数的二倍”,支撑这一结论的理论是______(填标号)
a 构造原理 b 泡利原理 c 洪特规则 d 能量最低原理
(3)在周期表中,Se与As、Br同周期相邻,与S、Te同主族相邻。Te、As、Se、Br的第一电离能由大到小排序为_______。
(4)H2O2和H2S的相对分子质量相等,常温下,H2O2呈液态,而H2S呈气态,其主要原因是______;![]() 的中心原子杂化类型为_______,其空间构型为_______。
的中心原子杂化类型为_______,其空间构型为_______。
(5)ZnO具有独特的电学及光学特性,是一种应用广泛的功能材料。
①已知锌元素、氧元素的电负性分别为1.65、3.5,ZnO中化学键的类型为______。ZnO可以被NaOH溶液溶解生成[Zn(OH)4]2—,请从化学键角度解释能够形成该离子的原因。_______。

②一种ZnO晶体的晶胞如图所示。晶胞边长为a nm、阿伏加德罗常数的值为NA,其晶体密度为________g·cm3。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向10 mL 0.10 mol·L-1CuCl2溶液中滴加0.10 mol/L mol·L-1硫化钠溶液,滴加过程中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示。下列说法正确的是

A. Ksp(CuS)的数量级是10-35
B. 曲线上a点溶液中,c(S2-) c(Cu2+)>Ksp(CuS)
C. a、b、c 三点溶液中,c(H+)和c(OH-)的积最小的为b点
D. c 点溶液中:c(Na+)>c(Cl-)>c(S2-)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中正确的是( )
A. 能电离出H+的化合物除水外都是酸,分子中含有几个氢原子它就是几元酸
B. 无机含氧酸分子中含有几个羟基,它就属于几元酸
C. 同一元素的含氧酸,该元素的化合价越高,其酸性越强,氧化性也越强
D. H3PO4和H2CO3分子中非羟基氧的个数均为1,但它们的酸性不相近,H3PO4是中强酸而H2CO3是弱酸
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于晶体的说法一定正确的是( )

(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点)
A. 分子晶体中都存在共价键
B. CaTiO3晶体中每个Ti4+和12个O2-相紧邻
C. SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D. 金属晶体的熔点都比分子晶体的熔点高
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)AlCl3溶液呈________性(填“酸”“中”或“碱”),原因是____________________________(用离子方程式表示)。把AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是____________________(写化学式)。实验室在保存AlCl3溶液时,常在溶液中加少量的________,以抑制其水解。
(2)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈________性(填“酸”“中”或“碱”),溶液中[Na+]________[CH3COO-](填“>”“=”或“<”)。
(3)25 ℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈________性(填“酸”“中”或“碱”),溶液中,[Na+]________[CH3COO-](填“>”“=”或“<”)。
(4)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈________性(填“酸”“中”或“碱”),醋酸体积________氢氧化钠溶液体积(填“>”“=”或“<”)。
(5)已知0.1 mol·L-1的NaHCO3溶液pH=9,则溶液中[CO32-]________[H2CO3](填“>”“=”或“<”),其溶液显电中性的原因是________________________(用离子浓度关系式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示晶体结构是一种具有优良的电压、电光等功能的晶体材料的最小结构单元(晶胞).晶体内与每个“Ti”紧邻的氧原子数和这种晶体材料的化学式分别是(各元素所带电荷均已略去)( )
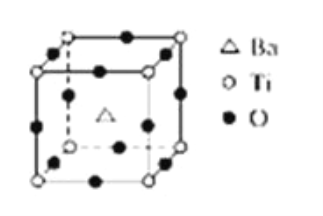
A. 8;BaTi8O12
B. 8;BaTi4O9
C. 6;BaTiO3
D. 3;BaTi2O3
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)利用VSEPR推断分子或离子的空间构型。
PO![]() __________;CS2____________;AlBr3(共价分子)__________。
__________;CS2____________;AlBr3(共价分子)__________。
(2)有两种活性反应中间体粒子,它们的粒子中均含有1个碳原子和3个氢原子。请依据下面给出的这两种粒子的球棍模型,写出相应的化学式:
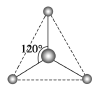 ______________;
______________;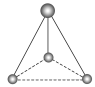 ______________。
______________。
(3)按要求写出第二周期非金属元素构成的中性分子的化学式。
平面三角形分子________,三角锥形分子________,四面体形分子________。
(4)为了解释和预测分子的空间构型,科学家在归纳了许多已知的分子空间构型的基础上,提出了一种十分简单的理论模型——价层电子对互斥模型。这种模型把分子分成两类:一类是____________________;另一类是____________________。
BF3和NF3都是四个原子的分子,BF3的中心原子是________,NF3的中心原子是________;BF3分子的立体构型是平面三角形而NF3分子的立体构型是三角锥形的原因是____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1一种工业合成氨的简易流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1一种工业合成氨的简易流程图如下:
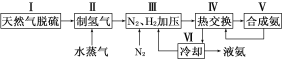
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___________________________。
(2)步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是________。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO转化率为__________________。
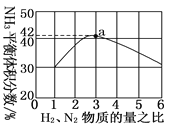
(3)如图表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素a、b、c、d的原子序数依次增大,a和b的最外电子数之和等于c和d的最外层电子数之和,这四种元素组成两种盐b2da3和bca2。在含该两种盐的混合溶液中滴加盐酸,产生白色沉淀的物质的量与盐酸体积的关系如图所示。下列说法正确的是

A. 1mol d的氧化物含2mol 化学键
B. 工业上电解c的氧化物冶炼单质c
C. 原子半径:a < b < c < d
D. 简单氢化物的沸点:a < d
查看答案和解析>>
科目: 来源: 题型:
【题目】以石墨负极(C)、LiFePO4正极组成的锂离子电池的工作原理如图所示(实际上正负极材料是紧贴在锂离子导体膜两边的)。充放电时,Li+在正极材料上脱嵌或嵌入,随之在石墨中发生了LixC6生成与解离。下列说法正确的是

A. 锂离子导电膜应有保护成品电池安全性的作用
B. 该电池工作过程中Fe元素化合价没有发生变化
C. 放电时,负极材料上的反应为6C+xLi++ xe- =LixC6
D. 放电时,正极材料上的反应为LiFePO4 - xe- = Li1-xFePO4 + xLi+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com