
科目: 来源: 题型:
【题目】一定条件下,将NO2 与SO2 以体积比1:2 置于恒容密闭容器中发生反应: ![]() 。下列能说明该反应达到平衡状态的是
。下列能说明该反应达到平衡状态的是
A. v(SO3 ) = v(NO2 ) B. 混合气体的密度保持不变
C. 混合气体的颜色保持不变 D. 每消耗1 mol SO3 的同时生成1 mol NO2
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究SO2的化学性质,设计了如图系列实验。
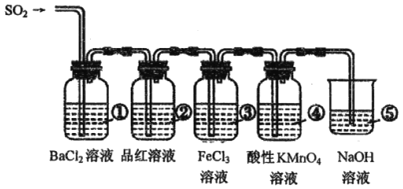
(1)①中开始时无现象,放置一段时间后,出现白色浑浊,写出有关的三个反应的化学方程式:___、___、___;
(2)③中发生反应后的铁元素的价态为___。
(3)试写出④⑤中反应的离子方程式:___、___。
(4)若通入的气体改为CO2,那么①②③④中哪个会出现与SO2不同的现象?___(填序号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】锆(![]() )是现代工业的重要金属原料,具有良好的可塑性,抗蚀性能超过钛。以锆英石(主要成分是
)是现代工业的重要金属原料,具有良好的可塑性,抗蚀性能超过钛。以锆英石(主要成分是![]() ,还含有少量
,还含有少量![]() 等杂质)为原料生产锆及其化合物的流程如图所示
等杂质)为原料生产锆及其化合物的流程如图所示
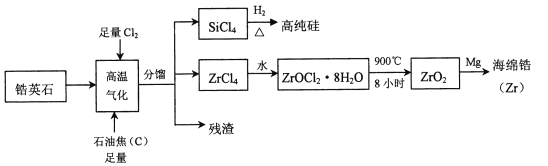
(1)写出![]() 的电子式____________________。
的电子式____________________。
(2)高温气化过程中,不考虑损失,发现分馏后得到的![]() 质量通常比由纯
质量通常比由纯![]() 发生的反应得到的
发生的反应得到的![]() 质量大,用化学方程式来解释原因_________________________。
质量大,用化学方程式来解释原因_________________________。
(3)高温气化后的固体残渣除碳外,还有![]() 和
和![]() ,加水浸取得氯化铁溶液,过滤,从滤渣中分离出碳和
,加水浸取得氯化铁溶液,过滤,从滤渣中分离出碳和![]() 两种固体的方法是____________________。
两种固体的方法是____________________。
(4)写出上述流程中![]() 与水反应的化学方程式:____________________________。
与水反应的化学方程式:____________________________。
(5)已知氧化锆(![]() )是一种两性氧化物,与氢氧化钠共熔融可形成酸盐,请写出化学方程式_________________________________________。
)是一种两性氧化物,与氢氧化钠共熔融可形成酸盐,请写出化学方程式_________________________________________。
(6)工业上可用钾还原![]() 时制得金属
时制得金属![]() ,
,![]() 被还原时生成的钾盐的物质的量为_________________。
被还原时生成的钾盐的物质的量为_________________。
(7)已知![]() ,
,![]() 。下列说法正确的是__________
。下列说法正确的是__________
A.![]() ,电解质溶液的
,电解质溶液的![]() 与
与![]() 之和均为14
之和均为14
B.用盐酸滴定某浓度的![]() 溶液,滴定过程中
溶液,滴定过程中![]() 逐渐增大
逐渐增大
C.![]() 溶液中逐滴加入硫酸溶液,滴加过程中
溶液中逐滴加入硫酸溶液,滴加过程中![]() 逐渐减小
逐渐减小
D.某温度下![]() ,则其溶液中
,则其溶液中![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下联氨(![]() )的水溶液中有:① N2H4+H2O
)的水溶液中有:① N2H4+H2O![]() N2H5++OH- K1
N2H5++OH- K1
② N2H5++H2O![]() N2H62++OH- K2,该溶液中微粒的物质的量分数
N2H62++OH- K2,该溶液中微粒的物质的量分数![]() 随
随![]() 变化的关系如图所示。下列叙述错误的是
变化的关系如图所示。下列叙述错误的是
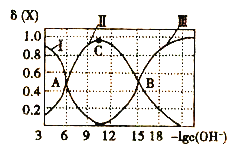
A. 图中Ⅲ对应的液粒为![]()
B. 由图可知,![]()
C. 若![]() 点为
点为![]() 溶液,则存在:
溶液,则存在:![]()
D. 反应②为![]() 的水解方程式
的水解方程式
查看答案和解析>>
科目: 来源: 题型:
【题目】请按要求书写下列离子方程式:
①将过量CO2通入澄清石灰水中,反应的离子方程式为_____________________。
②Ca(HCO3)2溶液与少量Ca(OH)2溶液反应的离子方程式为___________________。
③少量Ba(OH)2溶液与NaHSO4溶液反应的离子方程式为_____________。
④已知酸性环境下,ClO-可将Mn2+氧化成MnO2,自身被还原成Cl-,该过程的离子反应方程式为__。
⑤在酸性条件下,向含铬废水中加入FeSO4溶液,可将Cr2O![]() 还原为Cr3+,该过程的离子反应方程式为___。
还原为Cr3+,该过程的离子反应方程式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】一种新型的“电池的正极采用含有![]() 的水溶液,负极采用固体有机聚合物[用An, (Ali)n表示],电解质溶液采用
的水溶液,负极采用固体有机聚合物[用An, (Ali)n表示],电解质溶液采用![]() 溶液,聚合物离子交换膜作为隔膜将液态正极和固态负极分隔开(原理示意图如图)。已知含
溶液,聚合物离子交换膜作为隔膜将液态正极和固态负极分隔开(原理示意图如图)。已知含![]() 的溶液呈棕黄色,下列有关判断正确的是
的溶液呈棕黄色,下列有关判断正确的是

A. 图甲是原电池工作原理图,图乙是电池充电原理图
B. 放电时,正极液态电解质溶液的颜色变浅
C. 放电时,![]() 从右向左通过聚合物离子交换膜
从右向左通过聚合物离子交换膜
D. 放电时,负极的电极反应式为:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
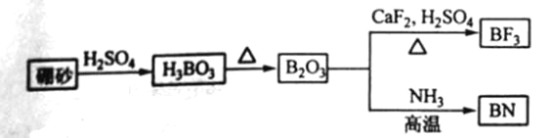
请回答下列问题:
(1) 由B2O3制备BF3、BN的化学方程式依次是_________、__________;
(2) 基态B原子的电子排布式为_________;B和N相比,电负性较大的是_________,BN中B元素的化合价为_________;
(3) 在BF3分子中,F-B-F的建角是_______,B原子的杂化轨道类型为_______,BF3和过量NaF作用可生成NaBF,BF的立体结构为_______;
(4) 在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________;
(5)六方氢化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶苞边长为361.5pm,立方氮化硼晶苞中含有______各氮原子、________各硼原子,立方氮化硼的密度是_______g·![]() (只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学用语正确的是
A. NaHCO3的水解:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. 醋酸的电离:CH3COOH=CH3COO-+H+
C. H2的燃烧热为285.8 kJ/mol,则表示H2燃烧热的热化学方程式为:H2(g)+1/2O2(g)=H2O(g) ΔH=-285.8 kJ/mol
D. 碳酸钙的溶解平衡:CaCO3(s)![]() Ca2+(aq)+CO32-(aq)
Ca2+(aq)+CO32-(aq)
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室可用如下方法制取Cl2,根据相关信息,回答下列问题:
(1)用双线桥法表示电子转移方向和数目_____:①MnO2 +4HCl(浓)=== Cl2↑+ MnCl2+ 2H2O
(2)若反应中有0.1mol的氧化剂被还原,则被氧化的物质为__(填化学式),被氧化的物质的量为 _____,同时转移电子数为_____。
(3)将(2)生成的氯气与 0.2mol H2 完全反应,生成的气体在标准状况下所占体积为_____L,将此产物溶于水配成100mL溶液,此溶液的物质的量浓度为_______。(已知:H2+Cl2![]() 2HCl)
2HCl)
(4)②KClO3+6HCl(浓)===3Cl2↑+KCl+3H2O③2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
若要制得相同质量的氯气,①②③三个反应中电子转移的数目之比为____。
(5)已知反应4HCl(g)+O2 ![]() 2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、O2、KMnO4三种物质氧化性由弱到强的顺序为_______。
2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、O2、KMnO4三种物质氧化性由弱到强的顺序为_______。
(6)将不纯的NaOH样品2.50 g(样品含少量Na2CO3和水),放入50.0 mL 2.00mol/L盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40.0 mL 1.00 mol/L的NaOH溶液。蒸发中和后的溶液,最终得到_____g固体。
查看答案和解析>>
科目: 来源: 题型:
【题目】人类农业生产离不开氮肥,科学合理使用氮肥,不仅能提高化肥的使用率,而且能够更好地保护环境,请回答下列问题:
(1)将N2转化为含氮化合物的过程称为固氮。
①人工固氮,将N2→NH3,N2发生___反应(填“氧化”或“还原”)
②自然界固氮,可将少量N2转化为Ca(NO3)2等氮肥,转化途径如下(转化所需试剂及条件已略去):N2→NO→NO2→HNO3![]() Ca(NO3)2。
Ca(NO3)2。
写出NO→NO2→HNO3的化学方程式___、___。
将HNO3转化为Ca(NO3)2,列举两种不同类别的化合物M___(写化学式)。
(2)科学合理地保存、施用氮肥。
①NH4HCO3需阴凉处保存,原因是___(写化学方程式)。
②铵态氮肥不能与碱性肥料混合使用,以NH4Cl为例写出发生反应的离子方程式___。
(3)过渡施用氮肥将导致大气中NH3含量增高,加剧雾霾的形成。(NH4)2SO4是雾霾的成分之一,其形成过程如图所示(转化所需试剂及条件已略去):
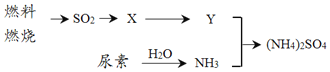
①Y与NH3反应生成(NH4)2SO4的化学方程式___。
②尿素CO(NH2)2是一种常用化肥,缓慢与H2O发生非氧化还原反应释放出NH3。则尿素中C元素化合价为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com