
科目: 来源: 题型:
【题目】短周期主族元素A、B、C、D、E的原子序数依次增加,K、L、M均是由这些元素组成的二元化合物,甲是B元素常见的固体单质,乙常温下呈液态。K是无色气体,是主要大气污染物之一。常温下0.05 mol L -1丙溶液pH为l,上述物质的转化关系如图所示。下列说法正确的是

A. 简单离子半径:C<D<E
B. 元素的非金属性:C>D>E>B
C. 由元素A、C、D仅能组成共价化合物
D. 由元素B、E组成的化合物可用于洗涤试管壁上残余的硫单质
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年4月20日,药品管理法修正草案进行二次审议,牢筑药品安全防线。运用现代科技从苦艾精油中分离出多种化合物,其中四种的结构如下:

下列说法不正确的是
A. ②③分子中所有的碳原子不可能处于同一平面内
B. ②、④互为同分异构体
C. ④的一氯代物有6种
D. ①②③均能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目: 来源: 题型:
【题目】把碎纸片b补充到a中,可得到一个完整的离子方程式(未配平)。下列说法正确的是( )

A. 反应物微粒是S、SO![]() 、OH-
、OH-
B. 该反应可能在酸性条件下进行
C. 氧化剂与还原剂的物质的量之比为2∶1
D. 2 mol S参加反应时,转移的电子数为3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】依据反应2KIO3+5SO2+4H2O═I2+3H2SO4+2KHSO4(KIO3过量),利用下列装置从反应后的溶液中制取碘的CCl4溶液并回收KHSO4。下列说法不正确的是
A. 用 制取SO2B. 用
制取SO2B. 用 还原IO3-
还原IO3-
C. 用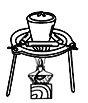 从水溶液中提取KHSO4D. 用
从水溶液中提取KHSO4D. 用 制取I2的CCl4溶液
制取I2的CCl4溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】苯分子中不存在碳碳单键、碳碳双键的交替结构,下列可以作为证据的事实是( )
①苯不能使酸性KMnO4溶液褪色
②苯不能因发生化学反应而使溴的四氯化碳溶液褪色
③苯在加热和有催化剂存在的条件下能与H2加成生成环己烷
④苯分子中碳碳键的键长完全相等
⑤邻二氯苯(![]() )只有一种
)只有一种
⑥间二氯苯(![]() )只有一种
)只有一种
A.①②B.①⑤C.③④⑤⑥D.①②④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温下部分弱电解质的电离平衡常数如下表:
化学式 | HF | HClO | H2CO3 | NH3·H2O |
电离常数 | 6.8×104 | 4.7×108 | K1=4.3×107 K2=5.6×1011 | Kb=1.7×105 |
(1)常温下,物质的量溶度相同的三种溶液①NaF溶液 ②NaClO溶液 ③Na2CO3溶液,其PH由大到小的顺序是___________(填序号)
(2)25°C时,PH=4的NH4Cl溶液中各离子浓度的大小关系为___________________
(3)NaClO溶液中的电荷守恒关系为_________________
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为_________
(5)常温下,0.1mol/L的氨水和0.1mol/L的NH4Cl溶液等体积混合,判断混合溶液的酸碱性____________(填“酸性”“碱性”“中性”)
查看答案和解析>>
科目: 来源: 题型:
【题目】磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,磁性材料广泛用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上用氯化铵焙烧锰矿粉制备高纯度碳酸锰的工艺流程如下:

已知:①锰矿粉的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属Mn+离子c(Mn+) ═ 0.1 mol L -1形成M(OH) n沉淀的pH范围如下:

③常温下,Ksp(CaF2) ═1.46×10-10 Ksp(MgF2) ═7.42×10-11 Ka(HF) ═1.00 ×10-4
回答下列问题:
(1)分析下列图1、图2,氯化铵焙烧锰矿粉的最佳条件是:__________________。

(2)“焙烧”时发生的主要反应的化学方程式为_________________________。
(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为__________;再调节溶液的pH将Al3+、Fe3+变为沉淀除去;然后加入NH4F将Ca2+、Mg2+沉淀除去,此时溶液pH为6,c(Mg2+)═4.64×10-6 mol·L-1,c(HF)为_________mol·L-1。
(4)碳化结晶时,反应的离子方程式为_____________________________________。
(5)碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液可能的原因是___________________。
(6)测定碳酸锰产品的纯度。
称取0.5000 g碳酸锰产品于锥形瓶中,加25.00 mL磷酸,加热,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至100 mL,滴加2~3滴指示剂,然后用浓度为0.2000 mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定(反应为:[Mn(PO4)2]3- +Fe2+ ═Mn2+ +Fe3++2PO43-)。重复操作3次,记录数据如下表:
滴定次数 | 0.2000 mol·L-1的硫酸亚铁铵标准溶液读数(mL) | |
滴定前 | 滴定后 | |
1 | 0.10 | 20.20 |
2 | 1.32 | 21.32 |
3 | 1.05 | 20.95 |
则产品的纯度=__________,若滴定终点时发现滴定管尖嘴处产生了气泡,则测得的碳酸锰粗产品的纯度___(填“偏高”“ 偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】A(C3H6)是基本有机化工原料,由A制备聚合物C和 合成路线如图所示(部分条件略去)。
合成路线如图所示(部分条件略去)。

已知: ,
,![]() R-COOH
R-COOH
(1)A的名称是_____________;B中含氧官能团名称是________________。
(2)C的结构简式________________;D→E的反应类型为________________
(3)E→F的化学方程式为___________________________。
(4)B的同分异构体中,与B具有相同官能团且能发生银镜反应,其中核磁共振氢谱上显示3组峰,且峰面积之比为6:1:1的是__________________(写出结构简式)。
(5)等物质的量的 分别与足量NaOH、NaHCO3 反应,消耗NaOH、NaHCO3 的物质的量之比为__________;检验
分别与足量NaOH、NaHCO3 反应,消耗NaOH、NaHCO3 的物质的量之比为__________;检验 其中一种官能团的方法是______________(写出官能团名称、对应试剂及现象)。
其中一种官能团的方法是______________(写出官能团名称、对应试剂及现象)。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用0.10 mol·L-1盐酸分别滴定20.00 mL浓度均为0.10 mol·L-1 CH3COONa溶液和NaCN溶液,所得滴定曲线如右图(忽略体积变化)。下列说法正确的是

A. 溶液中阳离子的物质的量浓度之和:点②等于点③
B. 点①所示溶液中:c(CN—)+ c(HCN)=2c(Cl—)
C. 点②所示溶液中:c(Na+)> c(Cl-)> c(CH3COO-)> c(CH3COOH)
D. 点④所示溶液中:c(Na+)+ c(CH3COOH)+ c(H+)>0.10 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生产生活、环境保护、资源利用等密切相关,下列说法正确的是
A. 大米、玉米、小麦中的淀粉经水解可变成乙醇
B. 利用二氧化碳制造全降解塑料,可以缓解温室效应
C. 测定氢氧化钠的熔点时,可以将氢氧化钠固体放入石英坩埚中高温加热
D. 海洋中含有丰富的矿产资源,仅利用物理方法可以获得![]() 和
和![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com