
科目: 来源: 题型:
【题目】氯气及许多含氯化合物是生产、生活中应用非常广泛的物质。磺酰氯(SO2Cl2)是实验室中常见试剂。已知:SO2Cl2(g)![]() SO2(g)+Cl2(g)
SO2(g)+Cl2(g)
(1)在2 L恒容密闭耐腐蚀性的容器中充入0.1 mol SO2Cl2(g)发生反应,在101 kPa、375K条件下进行该反应,SO2Cl2的转化率与时间关系如图所示。
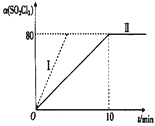
①平衡时,容器内压强p=_________________。
②相对曲线Ⅱ对应实验,仅改变一个条件得到曲线I,曲线I改变的条件可能是_____________________。
(2)一定量氯气用饱和纯碱溶液吸收恰好只生成三种盐(不产生气体),该溶液中阴离子浓度大小顺序为______________________________________________________。
(3)已知:常温下,次氯酸(HClO)的电离常数Ka=2.5×10-8,则在该温度下,NaClO水解反应的水解常数Kh为______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】中国科学院大连化学物理研究所的“甲醇制取低碳烯经(![]() 技术”获得国家科学技术发明一等奖,该技术先由煤气化制合成气再由合成气制甲醇和氨气,最后由甲醇制乙烯和丙烯。
技术”获得国家科学技术发明一等奖,该技术先由煤气化制合成气再由合成气制甲醇和氨气,最后由甲醇制乙烯和丙烯。
(1)煤气化包含一系列化学反应,已知热化学方程式:
![]()
![]()
![]()
![]()
则反应![]()
![]() _____
_____![]()
(2)以投料比![]() 合成甲醇:
合成甲醇:![]() ,温度、压强与
,温度、压强与![]() 的平衡转化率的关系如图所示
的平衡转化率的关系如图所示

回答下列问题:
①![]() _____(填>”或“<)0
_____(填>”或“<)0
②![]() ______(填“>“或“<”)
______(填“>“或“<”)![]()
③![]() ,
,![]() 时,
时,![]() 点的
点的![]() _____(填>”或"<")
_____(填>”或"<")![]() 。
。
④若起始时提高投料比![]() 的平衡转化率将_______(填”増大”或“减小”)。
的平衡转化率将_______(填”増大”或“减小”)。
⑤参照下表,实际工业生产中大多采用![]() 和
和![]() ,其优点是____________。
,其优点是____________。
span>方法 | 催化剂 | 条件 | 备注 | 特点 | |
压力 | 温度 | ||||
高压法 |
二元催化剂 | 25~30 | 380~400 | 1924年工业化 | (1)催化剂不易中毒,再生困难 (2)副反应多 |
低压法 |
三元催化剂 | 5 | 230~270 | 1966年工业化 | (1)催化剂易中毒,再生容易,寿命为1~2年 (2)副反应少 |
(3)![]() 和
和![]() 生成
生成![]() 的反应为
的反应为![]()
![]() ,在
,在![]() 催化剂作用下的反应历程如下(
催化剂作用下的反应历程如下(![]() 表示吸附态)
表示吸附态)
化学吸附:![]() ;
;![]()
表面反应![]() ;
;![]() ,
,![]()
脱附:![]()
其中,![]() 的吸附分解反应活化能高,速率慢,决定了合成氨的整体反应速率.
的吸附分解反应活化能高,速率慢,决定了合成氨的整体反应速率.
①有利于提高合成氨平衡产率的条件有______(填字母)
A 低温 B 高温 C 低压 D 高压 E 催化剂
②标准平衡常数![]() =
=![]() ,其中
,其中![]() 为标准压强(
为标准压强(![]() ),
),![]() 、
、![]() 和
和![]() 为各组分的平衡分压,如
为各组分的平衡分压,如![]() ,
,![]() 为平衡总压,
为平衡总压,![]() 为平衡系统中
为平衡系统中![]() 的物质的量分数.已知起始时向一密闭容器中投入
的物质的量分数.已知起始时向一密闭容器中投入![]()
![]() 和
和![]()
![]() ,反应
,反应![]()
![]() +
+![]()
![]()
![]()
![]() 在恒定温度和标准压强下进行,
在恒定温度和标准压强下进行,![]() 的平衡产率为
的平衡产率为![]() ,则该反应的
,则该反应的![]() =________(用含
=________(用含![]() 的代数式表示)。下图中可以表示标准平衡常数随温度
的代数式表示)。下图中可以表示标准平衡常数随温度![]() 的变化趋势的是____________(填字母)
的变化趋势的是____________(填字母)

查看答案和解析>>
科目: 来源: 题型:
【题目】以![]() 、软锰矿(主要成分为
、软锰矿(主要成分为![]() ,少量
,少量![]() 及
及![]() 的化合物等)、氨水及净化剂等为原料可制备
的化合物等)、氨水及净化剂等为原料可制备![]() 液和
液和![]() ,主要实验步骤如下
,主要实验步骤如下

步骤I、如图所示装置,将![]() 通入
通入![]() 中的软锰矿浆液中
中的软锰矿浆液中![]() 。
。
步骤II、充分反应后,在不断搅拌下依次向仪器![]() 中加入适量纯净的
中加入适量纯净的![]() ,最后加入适量
,最后加入适量![]() 沉铅,
沉铅,
步骤III、过滤得![]() 溶液
溶液
(1)仪器R的名称是_______。
(2)装置![]() 用于制取
用于制取![]() ,反应的化学方程式为_________。
,反应的化学方程式为_________。
(3)装置![]() 中的反应应控制在90~100℃,适宜的加热方式是______________。
中的反应应控制在90~100℃,适宜的加热方式是______________。
(4)装置![]() 的作用是______________________。
的作用是______________________。
(5)“步骤Ⅱ”中加入纯净![]() 的目的是_______________,用
的目的是_______________,用![]() 调节溶液
调节溶液![]() 时,需调节溶液
时,需调节溶液![]() 的范围为________(该实验条件下,部分金属离子开始沉淀和沉淀完全的
的范围为________(该实验条件下,部分金属离子开始沉淀和沉淀完全的![]() 如下表)
如下表)
金属离子 |
|
|
|
|
开始沉淀的 | 7.04 | 1.87 | 3.32 | 7.56 |
沉淀完全的 | 9.18 | 3.27 | 4.9 | 10.2 |
(6)已知①用空气氧化![]() 浊液可制备
浊液可制备![]() ,主要副产物为
,主要副产物为![]() ;反应温度和溶液
;反应温度和溶液![]() 对产品中
对产品中![]() 的质量分数的影响分别如图所示
的质量分数的影响分别如图所示

②反应温度超过![]() 时,
时,![]() 的产率开始降低,
的产率开始降低,![]() 是白色沉淀,
是白色沉淀,![]() 呈黑色;
呈黑色;![]() 、
、![]() 中锰的质量分数理论值依次为72.05%、62.5%请补充完整由步骤III得到
中锰的质量分数理论值依次为72.05%、62.5%请补充完整由步骤III得到![]() 溶液,并用氨水等制备较纯净的
溶液,并用氨水等制备较纯净的![]() 的实验方案:______________________,真空干燥6小时得产品
的实验方案:______________________,真空干燥6小时得产品![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有常温时pH=1的某强酸溶液10mL,下列操作能使溶液的pH变成2的是( )
A. 加入10mL 0.08mol·L-1的NaOH溶液 B. 加入100mL 的水进行稀释
C. 加水稀释成1L D. 加入10mL 0.01mol·L-1的盐酸溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】KMnO4是实验室中常用的一种试剂。回答下列问题:
(1)K+的结构示意图为___。
(2)在酸性高锰酸钾溶液中滴加过量的草酸(H2C2O4,弱酸)溶液,振荡,溶液紫色变无色。发生的化学反应为2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O,若将该反应设计成原电池,则负极反应式为___。
(3)在10mL0.1mol·L-1KMnO4溶液(含稀硫酸)中加入15mL0.5mol.L-1草酸溶液,收集到的CO2的量与时间的关系如图所示。

AB段反应速率增大的原因可能是___(填字母)。
a.该反应是放热反应
b.反应物浓度增大
c.K2SO4起催化作用
d.MnSO4起催化作用
(4)为了探究外界条件对化学反应速率的影响,设计如下方案:
实验 | 0.1mol·L-1KMnO4/mL | 0.5mol·L-1H2C2O4/mL | 0.1mol·L-1H2SO4/mL | 水浴 温度/℃ | 蒸馏水 /mL | 褪色时间 /min |
I | 5.0 | 15.0 | 5.0 | 35 | 0 | t1 |
II | 5.0 | 10.0 | 5.0 | 35 | V | t2 |
III | 5.0 | 15.0 | 3.0 | 35 | 2.0 | t3 |
IV | 5.0 | 15.0 | 5.0 | 45 | 0 | t4 |
①V=___。
②该实验方案不能探究对反应速率有影响的因素是___。
A.浓度 B.酸度 C.温度 D.催化剂
③若测得结果:t4<t1,则实验结论是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】E是合成某药物的中间体,其一种合成路线如图:

(1)A中含氧官能团的名称是___。
(2)A→B的反应条件和试剂是___。
(3)D→E的反应类型是___。
(4)写出B→C的化学方程式___。
(5)E的分子式为___。
(6)B的环上二溴代物有___种(不考虑立体异构)。
查看答案和解析>>
科目: 来源: 题型:
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、NO2等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2(g) + CO(g)![]() CO2(g) + NO(g)ΔH=-234 kJ/mol该反应的平衡常数为K1(下同)
CO2(g) + NO(g)ΔH=-234 kJ/mol该反应的平衡常数为K1(下同)
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol K2
2NO(g) ΔH=+179.5 kJ/mol K2
③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol K3
2NO2(g) ΔH=-112.3 kJ/mol K3
试写出NO与CO反应生成无污染物气体的热化学方程式____________________;
以及此热化学方程式的平衡常数K=________(用K1、K2、K3表示)。
(2)①一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图1所示。温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是________。
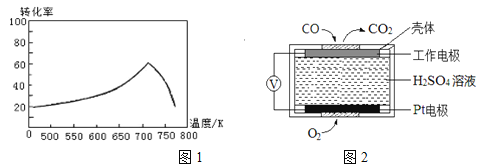
②已知:测定空气中NO和CO含量常用的方法有两种:
方法1:电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为____;
方法2:氧化还原滴定法。用H2O2溶液吸收尾气、将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度。写出NO与H2O2溶液反应的离子方程式:________________。
(3)NO2会污染环境,可用Na2CO3溶液吸收NO2 并生成CO2,已知9.2gNO2气体和Na2CO3溶液完全反应时转移电子0.1mol,恰好反应后,使得溶液中的CO2完全逸出,所得溶被呈弱碱性,则溶液中存在的所有离子浓度大小关系是____________________________。
(4)利用脱氮菌可净化低浓度NO废气。当废气在塔内停留时间均为90s的情况下,测得不同条件下NO的脱氮率如图I、Ⅱ所示。
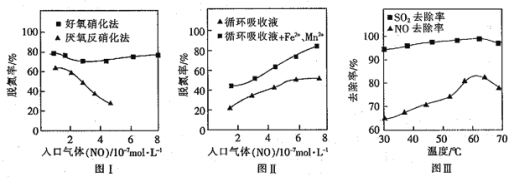
①由图I知,当废气中的NO含量增加时,宜选用___________法提高脱氮的效率。
②图Ⅱ中,循环吸收液加入Fe2+、Mn2+,提高了脱氮的效率,其可能原因为___________。
(5)研究表明:NaClO/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。图Ⅲ所示为复合吸收剂组成一定时,温度对脱硫脱硝的影响。温度高于60℃后,NO去除率下降的原因为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】人体血液存在H2CO3/HCO3—、HPO42-/H2PO4—等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值lg x[x表示![]() 或
或![]() ]与pH的关系如图所示。已知碳酸pKal═6.4、磷酸pKa2═7.2 (pKa═ -lgKa)。则下列说法不正确的是
]与pH的关系如图所示。已知碳酸pKal═6.4、磷酸pKa2═7.2 (pKa═ -lgKa)。则下列说法不正确的是

A. 曲线Ⅱ表示lg![]() 与pH的变化关系
与pH的变化关系
B. a~b的过程中,水的电离程度逐渐增大
C. 当c(H2CO3) ═c (HCO3—)时,c(HPO42—)=c(H2PO4—)
D. 当pH增大时,![]() 逐渐增大
逐渐增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com