
科目: 来源: 题型:
【题目】⑴有BaCl2和KCl的混合溶液V L,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀,消耗a mol H2SO4;另一份滴加AgNO3溶液,消耗b mol AgNO3使Cl-完全沉淀。原混合溶液中的K+的物质的量浓度为______mol/L。
⑵下列微粒:①S ②SO32- ③ Fe2+ ④Al3+ ⑤Na ⑥HCl ⑦Na2O2在化学反应中只能被氧化的是______![]() 填序号
填序号![]() ,只能表现出氧化性的是______
,只能表现出氧化性的是______![]() 填序号
填序号![]() 。
。
⑶一定条件下, PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为______mol;
⑷在一定条件下,实验室分别以过氧化氢、高锰酸钾、氯酸钾、过氧化钠为原料制取氧气,当制得同温同压下相同体积的氧气时,四个反应中转移的电子数之比为______。
⑸自来水中的NO3-对人类健康产生危害。为了降低自来水中NO3-的浓度,某研究人员提出在碱性条件下用Al粉还原NO3-,产物是N2发生的反应可表示如下,请完成方程式的配平。____Al + ____NO3-+ ________ == ____AlO2- + ____N2↑ +____ H2O,
⑹某化学反应的反应物和产物:![]()
①该反应的氧化产物是______。
②若该反应方程式中I2和KIO3的计量数分别是6和3,请在下边的化学式上用单线桥标出电子转移的方向和数目:KMnO4 + KI + H2SO4→______。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某同学测定盐酸的浓度在实验室中进行实验。请完成下列填空:
(1)配制100![]() 0.10
0.10![]() 标准溶液。
标准溶液。
①主要操作步骤:计算→称量→溶解→(冷却后)→洗涤(并将洗涤液移入容量瓶) →__________ →__________ →__________→将配制好的溶液倒入试剂瓶中,贴上标签。
②称量__________![]() 氢氧化钠固体所需仪器有:天平(带砝码、镊子)、__________、__________。
氢氧化钠固体所需仪器有:天平(带砝码、镊子)、__________、__________。
(2)取20.00 ![]() 待测盐酸放入锥形瓶中,并滴加2-3滴酚酞作指示剂,用自己配制的
待测盐酸放入锥形瓶中,并滴加2-3滴酚酞作指示剂,用自己配制的![]() 标准溶液进行滴定。重复上述滴定操作2-3次,记录数据如下。
标准溶液进行滴定。重复上述滴定操作2-3次,记录数据如下。
实验编号 |
| 滴定完成时, | 待测盐酸的体积/ |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
① 滴定达到终点的标志是__________。
② 根据上述数据,可计算出该盐酸的浓度约为__________(保留两位有效数字)。
③ 排除碱式滴定管中气的方法应采用如图所示操作中的__________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
④ 在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有__________(填字母序号)。
A. 滴定终点读数时俯视
B. 酸式滴定管使用前,水洗后未用待测盐酸润洗
C. 锥形瓶水洗后未干燥
D. 称量的![]() 固体中混有
固体中混有![]() 固体
固体
E. 碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,0.1 mol/L的HA溶液中c(H+)/c(OH-)=1010,0.01 mol/L的BOH溶液pH=12。请回答下列问题:
(1)HA是________(填“强电解质”或“弱电解质”,下同),BOH是_______。
(2)HA的电离方程式是____________________________________。
(3)在加水稀释HA的过程中,随着水量的增加而减小的是________(填字母)。
A.c(H+)/c(HA) B.c(HA)/c(A-) C.c(H+)与c(OH-)的乘积 D.c(OH-)
(4)在体积相等、pH相等的HA溶液与盐酸溶液中加入足量Zn,HA溶液中产生的气体比盐酸中产生的气体________(填“多”、“少”或“相等”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】
利用丙炔和苯甲醛研究碘代化合物与苯甲醛在 Cr-Ni 催化下可以发生偶联反应和合成 重要的高分子化合物Y的路线如下:

已知:①R1CHO+R2CH2CHO![]()
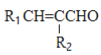 +H2
+H2
②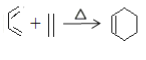
回答下列问题:
(1)A的化学名称为____。
(2)B中含氧官能团的名称是______。
(3)X的分子式为_______。
(4)反应①的反应类型是________。
(5)反应②的化学方程式是_______。
(6)L是D的同分异构体,属于芳香族化合物,与D具有相同官能团,其核磁共振氢谱为5组峰,峰面积比为3:2:2:2:1,则L的结构简式可能为_____。
(7)多环化合物是有机研究的重要方向,请设计由![]() 、CH3CHO、
、CH3CHO、![]() 合成多环化合物
合成多环化合物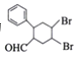 的路线(无机试剂任选)______。
的路线(无机试剂任选)______。
查看答案和解析>>
科目: 来源: 题型:
【题目】香豆素存在于黑香豆、香蛇鞭菊、野香荚兰、兰花中,具有新鲜干草香和香豆香,是一种口服抗凝药物。实验室合成香豆素的反应和实验装置如下:

可能用到的有关性质如下:
合成反应:
向三颈烧瓶中加入95%的水杨醛38.5g、新蒸过的乙酸酐73g和1g无水乙酸 钾,然后加热升温,三颈烧瓶内温度控制在145~150℃,控制好蒸汽温度。此时,乙酸开始蒸出。当蒸出量约15g时,开始滴加15g乙酸酐,其滴加速度应与乙酸蒸出的速度相当。乙酸酐滴加完毕后,隔一定时间,发现气温不易控制在120℃时,可继续提高内温至208℃左右,并维持15min至半小时,然后自然冷却。
分离提纯:
当温度冷却至80℃左右时,在搅拌下用热水洗涤,静置分出水层,油层用10%的 碳酸钠溶液进行中和,呈微碱性,再用热水洗涤至中性,除去水层,将油层进行减压蒸馏,收集150~160℃/1866Pa馏分为粗产物。将粗产物用95%乙醇(乙醇与粗产物的质量比为1:1)进行重结晶,得到香豆素纯品35.0g。
(1)装置a的名称是_________。
(2)乙酸酐过量的目的是___________。
(3)分水器的作用是________。
(4)使用油浴加热的优点是________。
(5)合成反应中,蒸汽温度的最佳范围是_____(填正确答案标号)。
a.100~110℃ b.117.9~127.9℃ c.139~149℃
(6)判断反应基本完全的现象是___________。
(7)油层用10%的碳酸钠溶液进行中和时主要反应的离子方程式为______。
(8)减压蒸馏时,应该选用下图中的冷凝管是_____(填正确答案标号)。
a.直形冷凝管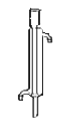 b.球形冷凝管
b.球形冷凝管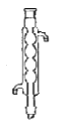 c.蛇形冷凝管
c.蛇形冷凝管
(9)本实验所得到的香豆素产率是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】S16O2与18O2在高温条件下发生反应2SO2+O2![]() 2SO3,达到化学平衡后,平衡混合物中含18O的微粒( )
2SO3,达到化学平衡后,平衡混合物中含18O的微粒( )
A. 只有SO3 B. 只有SO2、SO3 C. 有SO2、SO3、O2 D. 只有O2、SO3
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示:在B水槽中装有500 mL水,容积为a mL的试管A充满了NO2和NO的混合气体(标准状况),将试管A倒插入B水槽的水中。充分反应后,试管A中余下气体的体积为0.5a mL。
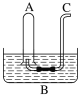
(1)将A倒插入B槽中发生反应的化学方程式为_______________________________________,该反应中氧化剂与还原剂的质量比为________,原混合气体中NO2和NO的物质的量之比为________。
(2)通过导气管C向余下0.5a mL气体的试管A中持续通入氧气,A中可能观察到的现象是_______________________________________________________________________。
(3)当试管A中充满气体时停止通入氧气,然后将试管取出水槽,水槽B中溶液的物质的量浓度为________ mol·L1(设溶液的体积仍为500 mL)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某酸式盐NaHY的水溶液c(OH-)>c(H+),下列叙述正确的是
A. H2Y的电离方程式:H2Y![]() 2H++Y2-
2H++Y2-
B. HY-的水解方程式:HY-+ H2O![]() H3O++ Y2-
H3O++ Y2-
C. 该酸式盐溶液中离子浓度关系:c(Na+)>c(HY-)>c(OH-)>c(H+)
D. 该酸式盐溶液中离子浓度关系:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,相同体积的0.5mol·L-1的下列四种溶液:①KCl溶液、②FeCl3溶液、③HF溶液、④Na2CO3溶液,其中所含阳离子数由多到少的顺序是( )
A. ④>①=②>③ B. ①>④>②>③ C. ④>①>③>② D. ④>②>①>③
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于盐类水解反应的应用说法正确的是( )
A.可以把FeCl3固体直接溶于水制FeCl3溶液
B.热的纯碱溶液去油污效果好
C.Al(NO3)3溶液与K2S溶液混合后无明显现象
D.Mg粉投入到饱和NH4Cl溶液中无明显现象
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com