
科目: 来源: 题型:
【题目】为了有效实现NO和NO2的相互转化,设计如下实验:按图组装好实验装置,并检查装置气密性,实验前用排水法收集半瓶NO气体。
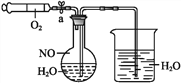
(1)打开止水夹,推动针筒活塞,使O2进入圆底烧瓶。关闭止水夹,首先观察到圆底烧瓶中的现象为_________,产生此现象的化学反应方程式为__。
(2)轻轻摇动圆底烧瓶,观察到圆底烧瓶中的现象为①___________;②________。产生此现象的化学反应方程式为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用Ca与H2反应制取氢化钙(CaH2)。下列实验装置和原理不能达到实验目的的是( )
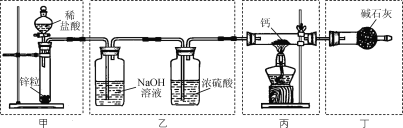
A. 装置甲制取H2B. 装置乙净化干燥H2
C. 装置丙制取CaH2D. 装置丁吸收尾气
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A. 使pH试纸显蓝色的溶液中:Na+、Mg2+、ClO-、HSO3-
B. c(Fe3+)=0.1 mol·L-1的溶液中:K+、NH4+、SO42-、SCN-
C. ![]() =0.1 mol·L-1的溶液中:Na+、HCO3-、K+、NO3-
=0.1 mol·L-1的溶液中:Na+、HCO3-、K+、NO3-
D. 0.1 mol·L-1的NaHCO3溶液中:NH4+、NO3-、Na+、SO42-
查看答案和解析>>
科目: 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12.某溶液中含有Cl-、Br-和CrO42-浓度均为0.010mol.L-1,向该溶液中逐滴加入0.010mol.L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A. Cl-、Br-、CrO42- B. CrO42-、Br-、Cl-
C. Br-、Cl-、CrO42- D. Br-、CrO42-、Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】合成中间体L的路线如下(部分反应条件或试剂略去):

已知: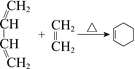
![]()

(1)A的名称是______。
(2)A与Br2按物质的量之比1︰1发生1,4-加成反应生成B,A→B的化学方程式是______。
(3)B→C的反应类型是______。
(4)D中所含官能团的名称是______。
(5)E与NaOH的乙醇溶液反应的化学方程式是______。
(6)C→D在上述合成中的作用是______。
(7)J的结构简式是______。
(8)K→L的化学方程式是______。
(9)设计由L制备M(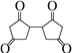 )的合成路线______(有机物用结构简式表示,无机试剂任选)。
)的合成路线______(有机物用结构简式表示,无机试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于反应2SO2+O2![]() 2SO3,下列判断正确的( )
2SO3,下列判断正确的( )
A. 标准状况下,2L SO2和足量O2反应最终生成2L SO3
B. 平衡时,再向容器中通入O2,可使SO2的转化率达到100%
C. 平衡时,SO2的消耗速率必定等于O2生成速率的二倍
D. 平衡时,SO2的浓度必定等于O2浓度的二倍
查看答案和解析>>
科目: 来源: 题型:
【题目】如图容器底部是培养基,其中含有植物生长所需的全部养分,如果有人在配制培养基的矿质元素中使用了NH4NO3、KNO3、CaCl2·2H2O、MgSO4·7H2O、螯合铁溶液、微量元素溶液,但缺少了一种必需元素,为补充这种元素,应添加的化合物是( )

A.Ca(NO3)2B.KClC.KH2PO4D.K2SO4
查看答案和解析>>
科目: 来源: 题型:
【题目】已知25℃时,醋酸溶液中存在下述关系:![]()
(1)当向该溶液中加入一定量盐酸时,上式中的数值是否发生变化_________ ?为什么_________?
(2)若醋酸的起始浓度为0.010 mol L-1,平衡时c(H+)是多少_________?
查看答案和解析>>
科目: 来源: 题型:
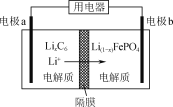
【题目】LiFePO4是一种电动汽车电池的电极材料,实验室以绿矾和磷酸为原料制备LiFePO4的流程如下:

(1)“溶解”和“反应1”步骤不能互换的原因是________。
(2)“反应1”的离子方程式是________。
(3)“反应2”是2LiOH+6H2C2O4+2FePO4===2LiFePO4+7CO2↑+5CO↑+7H2O,其中体现氧化性和还原性的反应物的物质的量之比为________。
(4)LiFePO4需要在高温下成型才能作为电极,高温成型时要加入少量活性炭黑,其作用是:①________,②________。
(5)利用LiFePO4作电极的电池稳定、安全、对环境友好,放电时工作原理如图所示。放电时电极b的电极反应式为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲溶液可能含有K+、Ca2+、NH4+、Cu2+、NO3-、Cl-、SO42-、CO32-八种离子中的若干种![]() 为确定甲溶液的组成,将其分成两等份,进行如下实验:
为确定甲溶液的组成,将其分成两等份,进行如下实验:
①向一份溶液中加入足量的NaOH浓溶液并加热,产生的气体在标准状况下体积为4.48L。
②向另一份溶液中加入0.6 mol/L的BaCl2溶液500mL,恰好可以与溶液中的离子完全反应,过滤得66.3g沉淀及滤液。
③向上述沉淀中加入过量的盐酸,产生的气体通入足量澄清的石灰水中,得到一定量的沉淀X。
④向上述滤液中加入1 mol/L AgNO3溶液650 mL,恰好可完全反应,据此,请回答下列问题![]() 用相应的离子符号表示
用相应的离子符号表示![]() :
:
⑴上述实验③中得到沉淀X的质量为______;生成沉淀X的离子方程式为______.
⑵甲溶液中一定不存在的离子是______;可能存在的离子是______.
⑶甲溶液一定存在的离子中,物质的量最大的离子是______;物质的量最小的离子是______,此物质的量最小的离子其物质的量为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com