
科目: 来源: 题型:
【题目】配制![]() 溶液。回答下列问题:
溶液。回答下列问题:
(1)需要固体NaCl________g。
(2)配制操作中,一定用不到的玻璃仪器是________![]() 填选项字母
填选项字母![]() 。还缺少的玻璃仪器是________。
。还缺少的玻璃仪器是________。
A.烧杯 ![]() 胶头滴管
胶头滴管 ![]() 玻璃棒
玻璃棒 ![]() 分液漏斗
分液漏斗
(3)若容量瓶中有少量蒸馏水,所配溶液的浓度将________![]() 填“偏大”、“偏小”或“无影响”,下同
填“偏大”、“偏小”或“无影响”,下同![]() ;若定容时仰视加水至刻度线,所配溶液的浓度将________。
;若定容时仰视加水至刻度线,所配溶液的浓度将________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是A→E五种含氮物质相互转化的关系图。其中A、B、C、D常温下都是气体,且B为红棕色气体。

(1)写出下列物质的化学式:
A___、B___、C___、D____、E___。
(2)写出下面各步反应的化学方程式:
①___、②___、⑤___。
查看答案和解析>>
科目: 来源: 题型:
【题目】把1 mol X气体和0.5 mol Y气体混合于2 L密闭容器中,发生如下反应:3X(g)+Y(g)![]() nZ(g)+2W(g),2 min末生成0.2 mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol/(L·min),试计算:
nZ(g)+2W(g),2 min末生成0.2 mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol/(L·min),试计算:
(1)前2 min内,用X表示的平均反应速率________;
(2)2 min末时Y的转化率________;
(3)化学方程式中Z的化学计量数n________。
查看答案和解析>>
科目: 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物的含量显得尤为重要。
I.氮氧化物研究
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应2NO(g)+O2(g)![]() 2NO2(g),下列各项能说明反应达到平衡状态的是 ________________(填字母代号) 。
2NO2(g),下列各项能说明反应达到平衡状态的是 ________________(填字母代号) 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗1 molO2同时生成2 molNO2
(2)汽车内燃机工作时会引起N2和O2的反应:N2 +O2![]() 2NO,是导致汽车尾气中含有NO的原因之一。在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g)+O2(g)
2NO,是导致汽车尾气中含有NO的原因之一。在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g)+O2(g)![]() 2NO(g)的△H__________0(填“>”或“<”)。
2NO(g)的△H__________0(填“>”或“<”)。

Ⅱ.碳氧化物研究
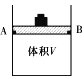
(1)体积可变(活塞与容器之间的摩擦力忽略不计)的密闭容器如右图所示,现将3molH2和2molCO放入容器中,移动活塞至体积V为2L,用铆钉固定在A、B点,发生合成甲醇的反应如下:CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
测定不同条件、不同时间段内的CO的转化率,得到如下数据:
T(℃) | 10min | 20min | 30min | 40min |
T1 | 20% | 55% | 65% | 65% |
T2 | 35% | 50% | a1 | a2 |
①根据上表数据,请比较T1_________T2(选填“>”、“<”或“=”);T2℃下,第30min 时,a1=________,该温度下的化学平衡常数为__________________。
②T2℃下,第40min时,拔去铆钉(容器密封性良好)后,活塞没有发生移动,再向容器中通入6molCO,此时v(正)________v(逆)(选填“>”、“<”或
(2)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合(混合后溶液体积变化忽略不计),充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则根据溶液中的电荷平衡可知,溶液的pH=___________,则可以求出醋酸的电离常数Ka =____________ (用含a和b的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学欲在实验室中完成Fe与水蒸气反应的实验,实验装置如图甲、乙所示。

已知B中放入的是铁粉与石棉绒的混合物,C中放的是干燥剂,E为酒精喷灯,G 为带有铁丝网罩的酒精灯。对比两装置,回答下列问题:
(1)如何检查乙装置的气密性?________________。
(2)乙装置中湿沙子的作用是________________。
(3)B处发生反应的化学方程式为_________________。
(4)该同学认为欲在乙装置的导管口处点燃反应产生的气体,装置H必不可少,H的作用是________________。
(5)对比甲、乙两装置的B和K,B的优点是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铝的利用成为人们研究的热点,是新型电池研发中重要的材料。
(1)通过以下反应制备金属铝。
反应1:Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g);ΔH1=akJ·mol-1
反应2:Al2O3(s)+3C(s)===2Al(l)+3CO(g);ΔH2=bkJ·mol-1
反应3:3AlCl(g)===2Al(l)+AlCl3(g);ΔH3
①反应3的ΔH3=_______kJ·mol-1。
②950℃时,铝土矿与足量的焦炭和Cl2反应可制得AlCl3。该反应的化学方程式是_______。
(2)在高温条件下进行反应:2Al(l)+AlCl3(g)![]() 3AlCl(g)。
3AlCl(g)。
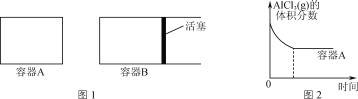
①向图1所示的等容积A、B密闭容器中加入足量的Al粉,再分别充入1 mol AlCl3(g),在相同的高温下进行反应。图2表示A容器内的AlCl3(g)体积分数随时间的变化图,在图2中画出B容器内AlCl3(g)体积分数随时间的变化曲线。__________
②1100℃时,向2 L密闭容器中通入3 mol AlCl(g),发生反应:3AlCl(g)=2Al(l)+AlCl3(g)。已知该温度下AlCl(g)的平衡转化率为80%,则该反应的平衡常数K=________。
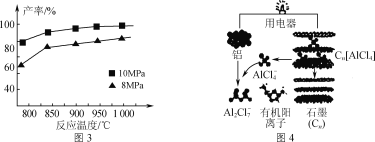
③加入3molAlCl(g),在不同压强下发生反应,温度对产率的影响如图3所示。此反应选择温度为900℃的原因是_______________。
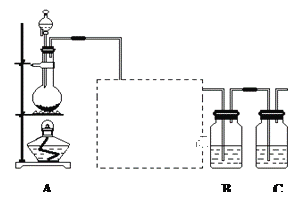
(3)用铝制作的快速放电铝离子二次电池的原理如图4所示。
①该电池充电时,阴极的电极反应式为_____。
②AlCl3和NaCl的熔融盐常用于镀铝电解池,电镀时AlCl4-和Al2Cl7-两种离子在电极上相互转化,其他离子不参与电极反应。NaCl的作用是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于氨水的叙述正确的是( )
A.氨水显碱性,是因为氨水是一种弱碱
B.氨水和液氨成分相同
C.氨水中物质的量浓度最大的粒子是NH3(除水外)
D.1mol·L-1的氨水指在1L溶液中含NH3、NH3·H2O、NH4+物质的量之和为1mol
查看答案和解析>>
科目: 来源: 题型:
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
(1)装置A的分液漏斗中盛装的试剂是___________,烧瓶中加入的试剂是___________,发生的离子反应方程式_____________________;
(2)虚线框内是一个装有未知试剂的广口瓶,该试剂是___________,说明装置的作用________________;
(3)装置B中盛放的试剂是______________(选填下列所给试剂的字母),实验现象为___________________,化学反应方程式是__________________________________;
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)已知:①硫酸比次氯酸稳定;②高氯酸比硫酸酸性强;③S2-比Cl-易被氧化;④HCl比H2S稳定;⑤铜与盐酸不反应,但能与浓硫酸反应;⑥铁与氯气加热生成三氯化铁,铁与硫加热生成硫化亚铁。可说明氯比硫非金属性强的是_________;
A.全部 B.②③④⑥ C.①②④⑤⑥ D.除①以外
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2甲烷化是一种实现CO2资源化利用的有效途径。
Ⅰ.热化学转化
CO2甲烷化过程发生反应:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)ΔH
CH4(g)+2H2O(g)ΔH
(1)每生成1mol CH4(g),放热165 kJ,则ΔH=______。
(2)反应的平衡常数的表达式:K=______。温度升高,K______(填“增大”或“减小”)。
(3)其他条件不变时,一段时间内,压强对CO2的转化率及CH4的选择性的影响如下图。

注:选择性=转化为目标产物的原料量÷原料总的转化量
CO2甲烷化反应选择0.1MPa而不选择更高压强的原因是______。
Ⅱ.电化学转化
多晶Cu可高效催化CO2甲烷化,电解CO2制备CH4的原理示意图如下。电解过程中温度控制在10℃左右,持续通入CO2。阴、阳极室的KHCO3溶液的浓度基本保持不变。

(4)多晶Cu作______(填“阴”或“阳”)极。
(5)结合电极反应式,说明阴极室KHCO3溶液浓度基本不变的原因:______。
(6)上述电解过程中采取了______措施(写2条即可)使CO2优先于H+放电。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D、E、F、G、H、I九种物质,其中A、B、D、E焰色反应均为紫色(透过蓝色钴玻璃),G、F是单质,其余均为化合物,H是一种淡黄色固体,它们的转化关系如图所示。请回答:

(1)画出G离子结构示意图________;
(2)写出B、I的化学式B________,I________;
(3)写出H的一种用途__________________________________;
(4)写出A受热分解的化学方程式_________________________;
(5)若H与C反应固体增重4.2 g,则参加反应的C气体在标准状况下的体积为________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com