
科目: 来源: 题型:
【题目】有机化合物甲与乙在一定条件下可反应生成丙:

下列说法正确的是
A. 甲与乙生成丙的反应属于取代反应
B. 甲分子中所有原子共平面
C. 乙的一氯代物有2种
D. 丙在酸性条件下水解生成 和CH318OH
和CH318OH
查看答案和解析>>
科目: 来源: 题型:
【题目】等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加入等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是
A. 甲、乙中都是铝过量 B. 甲中铝过量,乙中碱过量
C. 甲中酸过量,乙中铝过量 D. 甲中酸过量,乙中碱过量
查看答案和解析>>
科目: 来源: 题型:
【题目】利用微生物可实现苯酚(![]() )废水的净化,装置如图所示。下列有关说法正确的是
)废水的净化,装置如图所示。下列有关说法正确的是

A. a极的电极反应式为:C6H5OH-28e-+11H2O=6CO2↑+28H+
B. b极为正极,发生氧化反应
C. 中间室的Na+向左室移动
D. 右室生成0.1 mol N2时,用电器流过0.5 mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】主族元素W、X、Y、Z的原子序数依次增大,且均不大于20。Y元素原子的最外层电子 数是内层电子数的3倍,Z元素原子的最外层电子数是最内层电子数的一半。甲是W、X两种元素形成的简单化合物,水溶液呈碱性,乙是Y元素的单质。在工业生产中它们有如下转化关系。下列叙述正确的是

A. 原子半径的大小W<X<Y<Z
B. 戊与丁反应过程中氧化剂与还原剂的物质的量之比为1:2
C. Y与Z形成的所有化合物中只存在离子键
D. X元素的氧化物对应的水化物均为强酸
查看答案和解析>>
科目: 来源: 题型:
【题目】将1molN2气体和3molH2气体在2L的恒容容器中,并在一定条件下发生如下反应:N2(g)+3H2(g) ![]() 2NH3(g),若经2s后测得NH3的浓度为0.6mol·L-1,现有下列几种说法:其中不正确的是
2NH3(g),若经2s后测得NH3的浓度为0.6mol·L-1,现有下列几种说法:其中不正确的是
A. 用N2表示的反应速率为0.15mol·L-1·s-1 B. 2s时H2的转化率为40%
C. 2s时N2与H2的转化率相等 D. 2s时H2的浓度为0.6mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应A(g)+3B(g) ![]() 2C(g)+D(g) 在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
2C(g)+D(g) 在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
A.VA=0.15mol(Lmin)﹣1 B.VB=0.6 mol(Lmin)﹣1
C.VC=0.4 mol(Lmin)﹣1 D.VD=0.01 mol(Ls)﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的的是
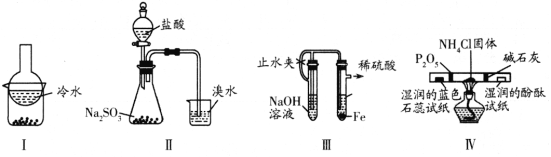
A. 加热装置Ⅰ中的烧杯分离I2和高锰酸钾固体
B. 用装置Ⅱ验证二氧化硫的漂白性
C. 用装置Ⅲ制备氢氧化亚铁沉淀
D. 用装置Ⅳ检验氯化铵受热分解生成的两种气体
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 0.1 mol NaHSO4固体中含有的离子总数为0.3NA
B. 1L 1 mo1·L-1的(NH4)2CO3溶液中所含NH4+的数目为2NA
C. 标况下,22.4L Cl2通入水中,转移的电子数为NA
D. 20g D2O含有的中子数为10NA
查看答案和解析>>
科目: 来源: 题型:
【题目】如下图所示可逆反应:mA(g) + nB(g) ![]() xC(g) ΔH = Q kJ/mol;在不同温度、压强下反应物A的转化率的变化情况。下列对于反应的热效应Q和反应方程式A、B、C的化学计量数的判断中,正确的是
xC(g) ΔH = Q kJ/mol;在不同温度、压强下反应物A的转化率的变化情况。下列对于反应的热效应Q和反应方程式A、B、C的化学计量数的判断中,正确的是

A. 上述反应是放热反应
B. 上述反应是吸热反应
C. m+n<x
D. m+n>x
查看答案和解析>>
科目: 来源: 题型:
【题目】著名化学家徐光宪在稀土领域贡献突出,被誉为“稀土界的袁隆平”。钇是稀土元素之一,我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),工业上通过如下工艺流程制取氧化钇,并获得副产物铍。

已知:ⅰ.钇(Y)的常见化合价为+3价;
ⅱ.铍和铝处于元素周期表的对角线位置,化学性质相似;
ⅲ.Fe3+、Y3+形成氢氧化物沉淀时的pH如下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 2.1 | 3.1 |
Y3+ | 6.0 | 8.3 |
(1)将钇矿石与NaOH共熔的反应方程式补充完整:
__Y2FeBe2Si2O10+__NaOH+____ ![]() __Y(OH)3 +__Fe2O3 + __Na2SiO3 + __Na2BeO2 + __H2O
__Y(OH)3 +__Fe2O3 + __Na2SiO3 + __Na2BeO2 + __H2O
(2)滤渣Ⅱ的主要成分是____________。
(3)试剂A可以是___________。
A.NaOH溶液 B.氨水 C.CO2 D.CaO
(4)用氨水调节pH=a时,a的取值范围是_____________________。
(5)计算常温下Y3+ +3H2O![]() Y(OH)3+3H+的平衡常数K=________。(常温下Ksp [Y(OH)3] = 8.0×10-23)
Y(OH)3+3H+的平衡常数K=________。(常温下Ksp [Y(OH)3] = 8.0×10-23)
(6)滤液Ⅲ加入氨水产生沉淀的离子方程式为_______________。
(7)从BeCl2溶液中得到BeCl2固体的操作是________。
(8)常见的由BeCl2固体生产Be的工业方法有两种:①电解法:电解NaCl-BeCl2混合熔融盐制备Be;②热还原法:熔融条件下,钾还原BeCl2制备Be。以上两种方法你认为哪种更好并请说明理由_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com