
科目: 来源: 题型:
【题目】某课外活动小组,将剪下的一块镀锌铁放入试剂瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞溶液,按图装置进行实验,数分钟后观察,下列现象不可能出现的是( )

A. B中导气管里形成一段水柱
B. B中导气管中产生气泡
C. 金属片剪口处溶液变红
D. 锌被腐蚀
查看答案和解析>>
科目: 来源: 题型:
【题目】以淀粉和油脂为原料,制备生活中某些物质。请回答:

(1)D中含有官能团的名称是________。
(2)反应④的有机反应类型是________。
(3)写出E可能的结构简式________。
(4)下列说法不正确的是______________ 。
A. 1mol D最多可以和3mol金属Na反应,生成标准状况下33.6L氢气
B. 葡萄糖、B以及淀粉这三者均能发生银镜反应
C. 反应①和反应②的反应类型相同
D. A和D有相同的官能团,两者属于同系物
查看答案和解析>>
科目: 来源: 题型:
【题目】反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如图所示,E1表示反应A+B→X的活化能。下列有关叙述正确的是
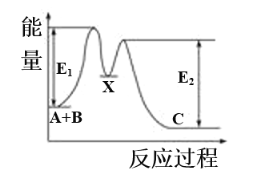
A. X是反应A+B→C的催化剂
B. 反应A+B→C的ΔH<0
C. E2表示反应X→C的活化能
D. 加入催化剂可改变反应A+B→C的焓变
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等。过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量。某研究小组拟用右图装置测定一定质量的样品中过氧化镁的含量。请回答:

(1)稀盐酸中加入少量FeCl3溶液的作用是________。
(2)使用恒压分液漏斗的优点有:使分液漏斗中的溶液顺利滴下;________。
(3)实验结束时,待恢复至室温,先________,再平视刻度线读数。
查看答案和解析>>
科目: 来源: 题型:
【题目】由W、X、Y、Z四种金属按下列装置进行实验。下列说法不正确的是
甲 | 乙 | 丙 | |
装置 |
|
|
|
现象 | 金属W不断溶解 | Y 的质量增加 | W上有气体产生 |
A.四种金属的活动性强弱顺序为Z>W>Y>X
B.装置乙中Y电极上的反应式为Cu2++2e=Cu
C.装置甲中X作原电池正极
D.装置丙中溶液的c(H+)减小
查看答案和解析>>
科目: 来源: 题型:
【题目】写出下列电解质在水溶液中的电离方程式
NaHCO3 _______________________.
CH3COOH _______________________.
Fe(OH)3_______________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈_______(填“酸性”,“中性”或“碱性”),溶液中c(Na+) _______c(CH3COO-)(填“ >” 或 “=”或“<”)。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈_______(填“酸性”,“中性”或“碱性”),溶液中c(Na+)_______c(CH3COO-) (填“ >” 或“=”或“<”)。
(3)酸碱中和反应是_______反应 ,盐类水解是_______反应,(填吸热,放热)。盐类水解的本质是_______水的电离,(填促进,抑制)。升高温度_______盐类的水解。(填促进,抑制)
(4)弱电解质的电离常数只受_______影响,升温电离常数_______
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化亚铜(CuCl)广泛应用于有机合成、染料、颜料、催化剂等工业。它是一种白色粉末,微溶于水,不溶于乙醇、稀硝酸及稀硫酸,可溶于氨水、浓盐酸,并生成配合物NH4[CuCl2];能在空气中迅速被氧化成绿色;见光则分解,变成褐色。下图是实验室制备氯化亚铜的流程图及实验装置图。
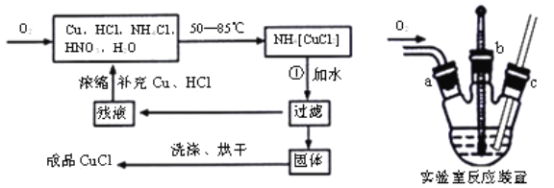
实验药品:铜丝20g、氯化铵20g、65%硝酸l0mL、36%盐酸15mL、水。
(1)请写出①的化学方程式____________________________________。
(2)本实验中通入O2的速率不宜过大,宜选择下图中的____(填字母序号)方案,并说明选择该装置的理由__________________________________________。
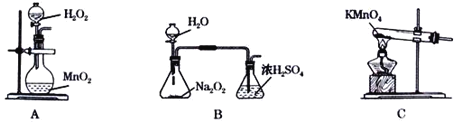
(3)电炉加热升温至50℃时停止加热,反应快速进行,当烧瓶中液面上方的现象为_____时,停止通入氧气,打开瓶塞,沿C口倾出反应液于l000mL大烧杯中,加水500mL,即刻有大量白色沉淀析出。
(4)关于该实验过程中,下列说法正确的是_________________。
A 实验开始时,温度计显示反应液温度可能低于室温。
B 流程中过滤操作,可以采用真空抽滤的方式,洗涤固体可以用95%的酒精。
C 该实验流程中,残液中补充HCl的主要作用是抑制产物的水解。
D 反应装置中使用长导管的目的是防止三颈烧瓶内气压过大。
(5)氯化亚铜的定量
①称取成品0.25g置于预先放入玻璃珠30粒和l0mL过量的FeCl3溶液的250mL锥形瓶中,不断摇动;
②待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
③立即用0.l0 mol·L-1硫酸铈标准溶液滴至绿色出现为终点并记录读数,再重复实验二次,测得数据如下表。(已知:CuCl + FeCl3 = CuCl2 + FeCl2 ,Fe2+ + Ce4+ = Fe3+ + Ce3+)
实验序号 | 1 | 2 | 3 |
滴定起始读数(mL) | 0.75 | 0.50 | 0.80 |
滴定终点读数(mL) | 24.70 | 24.95 | 24.85 |
④数据处理:计算得CuCl的纯度为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】1980年Smith Kline & French(英国)开发了一种叫盐酸卡布特罗的有机物,它是一种用于治疗支气管的药物,其合成路线如下:

已知:① ![]() ②
② ![]()
(1)下列说法不正确的是_____________。
A. 化合物A能使酸性高锰酸钾溶液褪色 B. 试剂X能够和盐酸反应
C. 1mol化合物G最多能和4mol氢氧化钠溶液反应 D. 反应⑤的反应类型为加成反应
(2)化合物G的结构简式________。
(3)写出④的化学方程式________。
(4)已知:①苯环上有甲基或乙基时,新取代基主要在邻位或对位;
②苯环上有羧基或酯基时,新取代基主要在间位。
结合上述合成路线,请设计以乙苯、ClCH2OH、(CH3)2NH为原料合成 ![]() 的合成路线(用流程图表示,无机试剂任选),示例如下:
的合成路线(用流程图表示,无机试剂任选),示例如下:
![]() ________
________
(5)写出同时满足下列条件的X的所有同分异构体的结构简式________。
①有苯环;②核磁共振氢谱有4个峰。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳氢化合物有多种,它们在工业生产、生活中有重要用途。
(1)工业上可由丁烯(C4H8)来制备丙烯(C3H6)和乙烯(C2H4),其主要反应原理为:
反应I:C4H8 (g) ![]()
![]() C3H6(g) ΔH1
C3H6(g) ΔH1
反应II:C4H8(g) ![]() 2C2H4 (g) ΔH2
2C2H4 (g) ΔH2
①已知烃的裂解是吸热反应,则ΔH1________ΔH2(填“>”、 “=”或“<”)。
②若某温度下反应达到平衡时C4H8、C3H6、C2H4的体积分数分别为20%、70%、10%,平衡时总压强为P,请计算该温度下反应II的平衡常数Kp=________(Kp为用气体的分压表示的平衡常数,分压=气体的体积分数×体系总压)
(2)石油危机日渐严重,甲烷的转化和利用在天然气化工行业有非常重要的作用。甲烷重整技术主要是利用甲烷和其他原料来制备合成气(CO和H2混合气体)。现在常见的重整技术有甲烷-水蒸气重整,甲烷-二氧化碳重整,其反应分别为:
CH4(g) + H2O(g) ![]() CO(g) + 3H2(g) ΔH>0
CO(g) + 3H2(g) ΔH>0
CH4(g) + CO2(g) ![]() 2CO(g) + 2H2(g)
2CO(g) + 2H2(g)
①下图为反应压强为0.3 MPa,投料比n(H2O)/n(CH4)为1,在三种不同催化剂催化作用下,甲烷-水蒸气重整反应中CH4转化率随温度变化的关系。
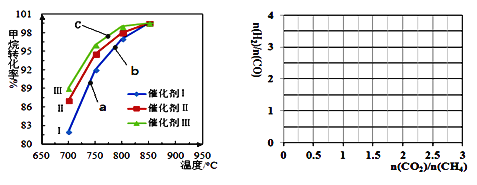
下列说法正确的是________。
A 在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是Ⅰ>Ⅱ>Ⅲ
B b点CH4的转化率高于a点,原因是b、a两点均未达到平衡状态,b点温度高,反应速率较快,故CH4的转化率较大
C C点一定未达到平衡状态
D 催化剂只改变反应速率不改变平衡移动,所以在850℃时,不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下达平衡时CH4的转化率相同
②催化剂Ⅰ也可以催化甲烷-二氧化碳重整。在催化剂Ⅰ催化下,反应温度850 oC ,n(H2O)/n(CH4)为1的体系中,加入CO2。画出反应达到平衡时n(H2)/n(CO)随进料时n(CO2)/n(CH4)的变化曲线。(已知:甲烷-二氧化碳重整的平衡常数>>甲烷-水蒸气重整反应的平衡常数)________ 。
(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如下图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子)。
①阳极的电极反应式为________。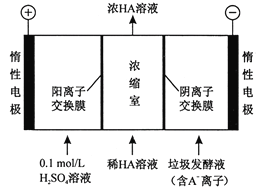
②电解过程中,采取一定的措施可控制阳极室的pH约为6~8,此时进入浓缩室的OH-可忽略不计。400 mL10 g/L 乳酸溶液通电一段时间后,浓度上升为 145 g/L(溶液体积变化忽略不计),则阴极上产生的H2在标准状况下的体积约为________L。(乳酸的摩尔质量为90g/ mol )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com