
科目: 来源: 题型:
【题目】实验室里也可以利用以下反应制取少量氯气:2KMnO4+16HCl(浓)![]() 2KCl+2MnCl2+8H2O+5Cl2↑,关于该反应的说法正确的是( )
2KCl+2MnCl2+8H2O+5Cl2↑,关于该反应的说法正确的是( )
A.KMnO4中的锰元素被氧化
B.Cl2既是氧化产物,又是还原产物
C.HCl在反应中只做还原剂
D.每生成1molCl2转移电子的物质的量为2mol
查看答案和解析>>
科目: 来源: 题型:
【题目】t℃时CuSO4的溶解度是Sg,其饱和溶液密度为dg·cm-3,物质的量浓度为cmol·L-1。向足量饱和溶液中加入mg无水CuSO4或蒸发掉ng水后恢复t℃,均能获得Wg胆矾晶体,下列关系式正确的是
A. c=![]() mol·L-1 B. S=
mol·L-1 B. S=![]() g
g
C. m=![]() g D. W=
g D. W=![]() g
g
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验与对应示意图的关系正确的是( )
A.向 NaAlO2 溶液中逐滴 滴加盐酸至过量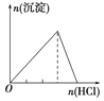
B.向 AlCl3 溶液中逐滴 滴加氨水至过量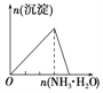
C.向明矾溶液中逐滴滴加Ba(OH)2 溶液至过量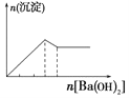
D.向澄清石灰水中缓缓 通入 CO2 至过量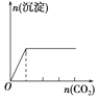
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组探究SO2气体的还原性,装置如图所示,下列说法不合理的是
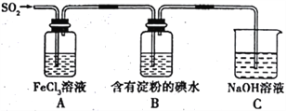
A. A装置中FeCl3溶液逐渐变为浅绿色,可以说明SO2有还原性
B. B装置中蓝色退去,说明还原性:SO2>I-
C. C装置中吸收尾气有可能倒吸
D. A、B装置中发生的反应转移电子数一定相等。
查看答案和解析>>
科目: 来源: 题型:
【题目】由硫铁矿(主要成分:FeS2和SiO2)为主要原料得到绿矾(FeSO4·7H2O)的流程如下:
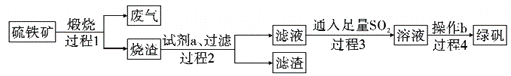
下列说法不正确的是( )
A. 过程1,废气中含SO2
B. 过程2,试剂a为稀硫酸
C. 过程3,离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
D. 过程4,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
查看答案和解析>>
科目: 来源: 题型:
【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是 ( )
选项 | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuSO4 | |
c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】387℃时,在甲、乙两个体积均为1.0L的恒容密闭容器中发生甲醇合成二甲醚的反应:2CH3OH(g)![]() CH3OCH3(g) + H2O(g),起始时、平衡时各物质的物质的量如下表所示。
CH3OCH3(g) + H2O(g),起始时、平衡时各物质的物质的量如下表所示。
容器 | 起始物质的量/mol | 平衡物质的量/mol | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | |
甲 | 0.20 | 0.080 | 0.080 |
乙 | 0.40 | a | a |
则:(1)表中a=________。
(2)若起始时向甲容器中充入0.20mol CH3OH(g)、0.50mol CH3OCH3和0.10molH2O(g),则反应达平衡时容器中CH3OH(g)的浓度为多少?_______(写出解题过程)
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-。当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )

A. 原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH4+
B. 反应最后形成的溶液中的溶质含AlCl3
C. 原溶液中Al3+与NH的物质的量之比为1∶3
D. 原溶液中含有的阴离子是Cl-、AlO2-
查看答案和解析>>
科目: 来源: 题型:
【题目】SNCR-SCR是一种新型的烟气脱硝技术(除去烟气中的NOx),其流程如下:

该方法中主要反应的热化学方程式为:4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) ΔH=-1646 kJ/mol,如图所示,反应温度会直接影响SNCR技术的脱硝效率。
4N2(g)+6H2O(g) ΔH=-1646 kJ/mol,如图所示,反应温度会直接影响SNCR技术的脱硝效率。
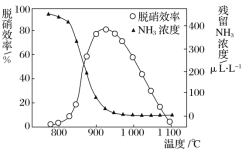
回答下列问题:
(1)SNCR技术脱硝的最佳温度选择925℃的理由是_______________________。
(2)SNCR与SCR技术相比,SNCR技术的反应温度较高,其原因是________________;
但当烟气温度高于1000℃时,SNCR脱硝效率明显降低,其原因可能是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮的氧化物(如NO2、N2O4、N2O5等)应用很广,在一定条件下可以相互转化。
(1)已知:N2O5在一定条件下发生分解2N2O5(g) ![]() 4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
T/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N2O5)/mol·L-1 | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
设反应开始时体系压强为p0,第2.00 min时体系压强为p,则p∶p0=________;1.00~3.00 min内,O2的平均反应速率为________。
(2)在N2O4与NO2之间存在反应:N2O4(g)![]() 2NO2(g)。将1 mol的N2O4放入1 L的恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
2NO2(g)。将1 mol的N2O4放入1 L的恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
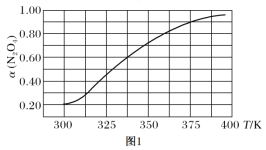
①337.5 K时,反应的平衡常数K=________(填写计算结果)。
②据图推测N2O4(g) ![]() 2NO2(g)是吸热反应,理由是_______________。
2NO2(g)是吸热反应,理由是_______________。
③对于反应N2O4(g)![]() 2NO2(g),用平衡时各组分压强关系表达的平衡常数
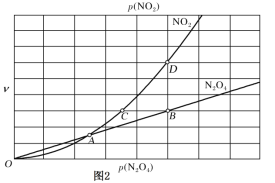
2NO2(g),用平衡时各组分压强关系表达的平衡常数![]() 。在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2· [p(NO2)]2。其中,k1、k2是与反应及温度有关的常数。相应的速率—压强关系如图所示:一定温度下,k1、k2与平衡常数Kp的关系是k1=________,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由___。
。在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2· [p(NO2)]2。其中,k1、k2是与反应及温度有关的常数。相应的速率—压强关系如图所示:一定温度下,k1、k2与平衡常数Kp的关系是k1=________,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com