
科目: 来源: 题型:
【题目】(1)下列几组物质中,互为同位素的是_______,互为同素异形体的是_______,互为同系物的是_______,互为同分异构体的是_______,属于同种物质的是_______。(用序号填空)
①O2 和O3 ②35Cl 和 37Cl ③CH3CH3 和 CH3CH2CH3④ 和
和 ⑤CH3(CH2)2CH3 和(CH3)2CHCH3
⑤CH3(CH2)2CH3 和(CH3)2CHCH3
(2)硫酸的性质有:A.高沸点;B.酸性;C.吸水性;D.脱水性;E.强氧化性。在下列硫酸的用途或化学反应中,硫酸可能表现上述的一个或者多个性质,试用字母填空:
①实验室干燥氢气_____;
②浓硫酸与金属铜的反应_____;
③浓硫酸使蔗糖变黑,且有刺激性气味的气体产生_____
(3)已知氯有 2 种常见同位素原子 35Cl、37Cl,氢有 3 种常见的同位素原子 H、D、T,氯气与氢气形成的氯化氢分子的相对分子质量可能有_____种。
(4)质量相同的 H2 16O 和 D2 16O 所含质子数之比为_____
(5)①CO2 ②CH3CH3 ③CaBr2 ④H2O2 ⑤NH4Cl ⑥AlCl3 ⑦NaOH ⑧NH3 ⑨Na2O2试用以上编号填空:既有极性键,又有非极性键的是_____;属于离子化合物的是_____;
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室利用废弃旧电池的铜帽(主要成分为Zn和Cu)回收Cu并制备ZnO的部分实验过程如图所示:
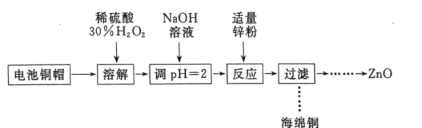
下列叙述错误的是( )
A. “溶解”操作中可用酸性条件下不断鼓入O2代替H2O2
B. 铜帽溶解后,将溶液加热至沸腾以除去溶液中过量的H2O2
C. 与加入锌粉反应的离子为Cu2+、H+
D. “过滤”操作后,将滤液蒸干、高温灼烧即可制取纯净的ZnO
查看答案和解析>>
科目: 来源: 题型:
【题目】双氧水是一种重要的绿色试剂,工业上可采取电解较稀浓度的硫酸来制取双氧水(H2O2为还原产物),其电解的化学方程式为:3H2O+3O2![]() O3+3H2O2。下列有关说法正确的是
O3+3H2O2。下列有关说法正确的是
A. 电解池的阳极生成双氧水,阴极生成臭氧
B. 电解池中H+移向阴极
C. 产生臭氧的电极反应式为3H2O+6e-=O3+6H+
D. 产生双氧水的电极反应式为2H2O-2e- =H2O2+2H+
查看答案和解析>>
科目: 来源: 题型:
【题目】有关下列四组实验描述不正确的是

A. 加热甲装置中的烧杯可以分离SiO2和NH4Cl
B. 利用装置乙可证明非金属性强弱:Cl>C>Si
C. 打开丙中的止水夹,一段时间后,可观察到烧杯内溶液上升到试管中
D. 向丁中铁电极区滴入2滴铁氰化钾溶液,一段时间后,烧杯中不会有蓝色沉淀生成
查看答案和解析>>
科目: 来源: 题型:
【题目】氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHClO3═bO2↑+cCl2↑+dHClO4+eH2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法不正确的是
A.由反应可推断氧化性:HClO4<HClO3
B.变蓝的淀粉碘化钾试纸褪色是因为可能发生了:5Cl2+I2+6H2O═12H++10Cl-+2IO3-
C.若氯酸分解所得混合气体,1 mol混合气体质量为47.6 g,则反应方程式可表示为26HClO3 ═15O2↑+8Cl2↑+10HClO4+8H2O
D.若化学计量数a=8,b=3,则该反应转移电子数为20e-
查看答案和解析>>
科目: 来源: 题型:
【题目】现有部分元素的性质与原子(或分子)结构的相关信息如表所示:
元素编号 | 元素性质与原子(或分子)结构的相关信息 |
T | 最外层电子数是次外层电子数的 3 倍 |
X | 常温下单质分子为双原子分子,分子中含有 3 对共用电子对 |
Y | M 层比K 层少 1 个电子 |
Z | 其离子是第三周期金属元素的离子中半径最小的 |
(1)T、X、Y、Z 形成的简单离子半径由大到小的顺序是_____。(用离子符号表示)
(2)元素 Y 与元素 Z 相比,金属性较强的是_____(用元素符号表示),下列表述中能 证明这一事实的是_____(填字母序号)。
a.Y 单质的熔点比 Z 单质的低
b.Y 的化合价比Z 的低
c.常温下Y 单质与水反应的程度很剧烈,而Z 单质在加热条件下才能与水反应
d.Y 最高价氧化物对应的水化物的碱性比 Z 的强
(3)T、X、Y、Z 中有两种元素能形成既含离子键又含非极性共价键的常见化合物,写出该化合物的电子式:________,元素 X 与氢元素以原子个数比 1∶2 化合形成常用于火箭燃料的化合物 W,写出 W 的电子式_______
(4)元素 T 和氢元素以原子个数比 1∶1 化合形成化合物 Q, Q 能与 W 发生氧化还原反应, 生成X 的单质和T 的另一种氢化物,写出该反应的化学方程式:_______
查看答案和解析>>
科目: 来源: 题型:
【题目】我国是干电池的生产和消费大国。某工厂用软锰矿(主要成分是MnO2,含少量Al2O3和SiO2)和闪锌矿(主要成分是ZnS,含少量FeS、CuS等杂质)为原料制备MnO2和Zn(干电池原料),其简化流程如下:
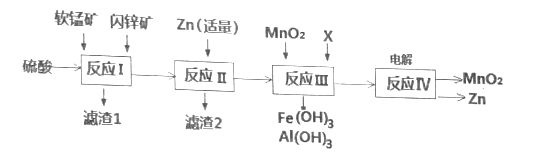
已知:经过反应Ⅰ后,所有金属元素均以离子形式存在。
回答下列问题:
(1)碱性锌锰干电池是以锌粉为负极,二氧化锰为正极,氢氧化钾溶液为电解质。电池总反应为2MnO2+Zn+2KOH=2MnOOH+K2ZnO2,请写出电池的正极反应式__________。
(2)滤渣1中除了SiO2以外,还有一种淡黄色物质,该物质是由MnO2、CuS与硫酸共热时产生的,请写出该反应化学方程式________________。
(3)反应Ⅱ中加入适量金属锌的目的是为了回收某种金属,请写出该反应的离子方程式______。
(4)反应Ⅲ中X可以是______。(填字母代号)
a.MgO b.Zn(OH)2 c.Cu2(OH)2CO3 d.MnCO3
(5)已知:H2S的电离常数K1=1.0×107,K2=7.0×1015。0.1 mol/L NaHS的pH___7(填“>”“=”或“<”)。
(6)在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L1 Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS浓度为1.0×104 mol·L1时,Mn2+开始沉淀,则a=________。[已知:Ksp(MnS)=1.4×1015]
查看答案和解析>>
科目: 来源: 题型:
【题目】NA 为阿伏加德罗常数的值,下列说法不正确的是( )
A.0.l mol Cl2与足量的铁粉充分反应转移的电子数为 0.2 NA
B.1.0 mol CH4 与Cl2 在光照下反应生成的 CH3Cl 分子数为 1.0 NA
C.标准状况下,11.2 L甲烷和乙烯(C2H4)混合物中含氢原子数目为2 NA
D.0.1mol Cl2 通入水中,HClO、Cl-、ClO-粒子数之和小于 0.2 NA
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法正确的是
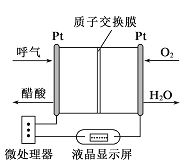
A. O2所在的铂电极处发生氧化反应
B. H+透过质子交换膜流向呼气所在的铂电极
C. 电路中流过2mol电子时,消耗标准状况下11.2LO2
D. 该电池的负极反应式为:CH3CH2OH+3H2O-12e-=2CO2+12H+
查看答案和解析>>
科目: 来源: 题型:
【题目】如图X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味气体放出,符合这一情况的是

a电极 | b电极 | X电极 | 电解质溶液 | |
A | Fe | 石墨 | 正极 | 稀硫酸 |
B | Zn | Cu | 负极 | CuSO4溶液 |
C | 石墨 | Pt | 负极 | AgNO3溶液 |
D | Pt | Cu | 正极 | CuCl2溶液 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com