
科目: 来源: 题型:
【题目】电解质在水溶液中存在各种行为,如电离、水解、沉淀溶解,据所学知识回答下列问题:
(1)t℃时,纯水中c(H+)=1×10-6 mol·L-1, 该温度下,pH=10的Ba(OH)2溶液的物质的量浓度为_________ mol·L-1。
(2)25℃时,将 a mol·L-1 的醋酸和 b mol·L-1 的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中c(CH3COO-)+c(CH3COOH)=__________ mol·L-1,a_______ b(填“﹥”、“﹤”或“=”)。
(3)工业上采取用氨水除去SO2,已知25 ℃,NH3 H2O的Kb=1.8×10-5,H2SO3的 Ka1=1.3 × 10一2,Ka2=6.2 × 10一8。若氨水的浓度为2.0 mo1/ L,溶液中的c(OH-)=_____ mo1/ L;将SO2通入该氨水中,当c(OH-)降至2.0 × 10一6mo1/ L时,溶液中的![]() =_____________。
=_____________。
(4)将AgCl分别放入:①5 mL水 ②10 mL 0.1 mol·L-1 MgCl2溶液③40 mL 0.3mol·L-1 盐酸溶液中溶解至溶液饱和 ④20 mL 0.5mol·L-1 NaCl溶液 ,各溶液中Ag+的浓度分别为a、b、 c、d,它们由大到小的排列顺序是____________(用字母表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是
A. 定性检验SO![]() ,将BaCl2溶液用HNO3酸化
,将BaCl2溶液用HNO3酸化
B. 为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液酸化
C. 检验溶液中是否含有Fe2+时,用硝酸酸化
D. 检验溶液中是否含有SO![]() 时,在无其他阳离子干扰的条件下,先用盐酸酸化,所得溶液再加BaCl2溶液
时,在无其他阳离子干扰的条件下,先用盐酸酸化,所得溶液再加BaCl2溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】(NH4)2Cr2O7可用作有机合成催化剂、媒染剂、显影液等。某化学兴趣小组对(NH4 )2Cr2O7的部分性质及组成进行探究。已知:Cr2O72-(橙色)+ H2O 2CrO42-(黄色)+ 2H+。请回答下列问题:
(1)取少量(NH4)2Cr2O7浓溶液于试管中,滴加足量浓KOH溶液,振荡、微热,观察到的主要现象是______________。
(2)为探究(NH4)2Cr2O7 (摩尔质量为252 g/mol)加热的分解产物,按下图连接好仪器,加热装置略去,在A中加入5.040 g样品进行实验。
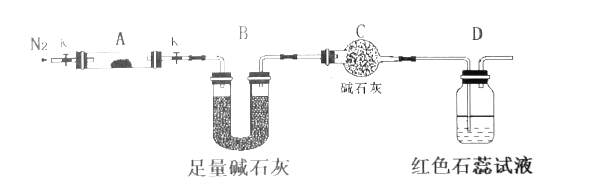
①仪器A的名称是______________。
②连接好装置,点燃酒精灯之前,先通入一段时间N2其目的为___________。
③反应结束后,依然要通一段时间的氮气的原因是________________________。
④加热A至恒重,观察到D中溶液不变色,同时测得A中残留物为Cr2O3、B中质量的变化为1.44 g,写出重铬酸铵加热分解反应的化学方程式:____________________。
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的样品中氮的质量分数(杂质不发生反应),其反应原理为 2Ba2++Cr2O72- + H2O = 2BaCrO 4↓+2H+、4NH4++6HCHO =3H++6H2O+(CH2)6N4H+ [滴定时,1 mo1 (CH2)6N4H+ 与 1 mo1 H+ 相当],然后用 NaOH 标准溶液滴定反应生成的酸。
实验步骤:称取样品5.600 g,配成500 mL溶液,移取25.00 mL样品溶液于 250 mL锥形瓶中,用氯化钡溶液使Cr2O72-完全沉淀后,加入10 mL 20.00 mol·L-1的中性甲醛溶液,摇匀、静置5 min后,加入12滴酚酞试液,用0.200 mo1 L-1 NaOH 标准溶液滴定至终点。重复上述操作3次,最终滴定用去NaOH标准溶液体积的平均值为16.00 mL。
①若滴定终点时,俯视读数,则测定结果_____(填“偏大” “偏小”或“无影响”)。
②滴定计算得该样品中氮的质量分数为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】1942年,我国化工专家侯德榜以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱,他的“侯氏制碱法”为世界制碱工业做出了突出贡献。有关反应的化学方程式如下:
NH3+CO2+H2O=NH4HCO3;
NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)“侯氏制碱法”把合成氨和纯碱两种产品联合生产,请写出工业合成氨的化学反应方程式_____。
(2)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是______。
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(3)某探究活动小组根据上述制碱原理,欲制备碳酸氢钠,同学们按各自设计的方案进行实验。
第一位同学:将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出)。

请回答:
①写出甲中发生反应的离子方程式______。
②乙装置中的试剂是______。
③实验结束后,分离出NaHCO3晶体的操作是______(填分离操作的名称)。
(4)第二位同学:用图中戊装置进行实验(其它装置未画出)。
①为提高二氧化碳在此反应溶液中被吸收的程度,实验时,须先从a管通入______气体,再从b管中通入______气体。
②装置c中的试剂为______(选填字母)。
e.碱石灰 f.浓硫酸 g.无水氯化钙
③若该同学进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组利用以下各装置连接成一整套装置,探究氯气与氨气之间的反应。其中D为纯净干燥的氯气与纯净干燥氨气反应的装置。

请回答下列问题:
(1)连接好装置后,必需进行的一步实验操作是_____________。
(2)装置E的作用是___,橡胶管k的作用是___________________。
(3)从装置D的G处逸出的尾气中可能含有黄绿色的有毒气体,处理方法是_________。
(4)装置F中试管内发生反应的化学方程式_______________。
(5)接入D装置的两根导管左边较长、右边较短,目的是__________.
(6)整套装置从左向右的连接顺序是(j)接(___)(___)接(f)(g)接(___)(___)接(___)(___)接(a)。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下.有浓度均为0.1 mol·L-l的下列4种溶液:①NaCN溶液 ②NaOH溶液 ③CH3COONa溶液 ④NaHCO3溶液
HCN | H2CO3 | CH3COOH |
Ka=4.9×10-10 | Ka1=4×10-7 Ka2=5.6×10-11 | Ka=1.7×10-5 |
(1)这4种溶液pH由大到小的顺序是____________(填序号)。
(2)④的水解平衡常数Kh= _________。
(3)若向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③_____ ④(填“>”、“<"、“=”)
(4)向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。NO在空气中存在如下反应:2NO(g)+ O2(g)![]() 2NO2(g) △H,上述反应分两步完成,如图所示。
2NO2(g) △H,上述反应分两步完成,如图所示。

回答下列问题:
(1)写出反应①的热化学方程式(△H用含物理量E的等式表示):___________。
(2)反应①和反应②中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是____(填“反应①”或“反应②”);对该反应体系升高温度,发现总反应速率变慢,其原因可能是_________(反应未使用催化剂)。
2NO2(g)反应速率的是____(填“反应①”或“反应②”);对该反应体系升高温度,发现总反应速率变慢,其原因可能是_________(反应未使用催化剂)。
(3)T1温度时在容积为2L的恒容密闭容器中只充入1.00molNO2气体发生反应:2NO(g)+O2(g)![]() 2NO2(g)。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO2)如表:
2NO2(g)。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO2)如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
①从0~2s该反应的平均速率v(NO2)=___________mol/(L·s)。
②T1温度时化学平衡常数K=___________mol-1·L。
③化学平衡常数K与速率常数![]() 、
、![]() 的数学关系是K=___________。若将容器的温度改变为T2时其
的数学关系是K=___________。若将容器的温度改变为T2时其![]() =
=![]() ,则T1__________T2 (填“>”、“<”或“=”)。
,则T1__________T2 (填“>”、“<”或“=”)。
(4)水能部分吸收NO、NO2混合气体得到HNO2溶液。向20 mL 0.10 mol/LHNO2溶液中逐滴加入0.10 mol·L-1 NaOH溶液,所得pH曲线如图所示。则A点对应的溶液中![]() =_______。
=_______。

查看答案和解析>>
科目: 来源: 题型:
【题目】请按要求回答下列问题:
(1)醇的官能团的名称是_____。
(2)某气态有机物相对于氢气的密度为14,则其结构简式为_____。
(3)某有机物的结构简式如图所示,则其一氯代物共有_____种。

(4)新戊烷用系统命名法命名应为_____。
(5)分别将等物质的量的C3H8、C4H8完全燃烧,消耗氧气质量多的是_____(填分子式)。
(6)下列最简式中,只能代表一种有机物的有_____(选填对应的序号)。
①CH3 ②CH2 ③CH2O ④CH4O
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:25 ℃时, Kb(NH3·H2O)=1.8×10-5。 该温度下,用 0.100mol·L-1 的氨水滴定 10.00 mL 0.100mol·L-1 的一元酸 HA 的溶液, 滴定过程中加入氨水的体积(V)与溶液中 的关系如图所示。下列说法不正确的是

A. HA 为强酸
B. a=10
C. 25 ℃时,NH4+的水解平衡常数为![]()
D. 当滴入 20 mL 氨水时,溶液中存在 c(NH4+)>c(A-)
查看答案和解析>>
科目: 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述中,正确的是
|
|
|
|
图Ⅰ 碱性锌锰电池 | 图Ⅱ 铅蓄电池 | 图Ⅲ 电解精炼铜 | 图Ⅳ 银锌纽扣电池 |
A. 图Ⅰ所示电池中,锌为负极,MnO2的作用是催化剂
B. 图II所示电池二氧化铅为正极,放电过程中硫酸浓度不变
C. 图III所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图IV所示电池工作过程中,Ag2O是氧化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com