
科目: 来源: 题型:
【题目】下列叙述错误的是( )
A. 在铁件上镀铜时,金属铜作阳极
B. 电解精炼粗铜时,电解质CuSO4溶液加少量硫酸是抑制 CuSO4水解
C. 纯锌与稀硫酸反应时,加入少量CuSO4,可使反应速率加快
D. 甲醇和氧气以及KOH溶液构成的新型燃料电池中,其负极上发生的反应为:CH3OH+6OH﹣+6e﹣═CO2+5H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】有关分子结构如图所示,下列叙述中,正确的是 ( )
![]()
A. 除苯环外的其余碳原子有可能都在一条直线上
B. 所有的原子都在同一平面上
C. 12个碳原子不可能都在同一平面上
D. 12个碳原子有可能都在同一平面上
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是 ( )
A. 自发反应一定是熵增大,非自发反应一定是熵减小
B. 常温下pH=10碳酸钠的溶液,由水电离出的H+浓度等于1×10-10mol/L
C. 可溶性盐在水中完全电离是强电解质,而难溶性盐在水中只能部分电离
D. 对于反应2X(g)+Y(g)![]() Z(g)ΔH>0,增加X的量,ΔH不变
Z(g)ΔH>0,增加X的量,ΔH不变
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示装置中, M棒变细,N棒变粗.由此判断下表中所列M、N、R物质,其中合理的是( )

M | N | R | |
A | 锌 | 铜 | 稀硫酸 |
B | 铜 | 铁 | 稀盐酸 |
C | 铁 | 铜 | 硝酸银 |
D | 铜 | 铁 | 氯化铁 |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:A _______ ,B________,C________,D________,E__________
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:____________ 。
(3)写出A、B两元素最高价氧化物的水化物相互反应的化学方程式:______________ 。
(4)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)_______________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-。当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )

A. 原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH4+
B. 反应最后形成的溶液中的溶质含AlCl3
C. 原溶液中Al3+与NH的物质的量之比为1∶3
D. 原溶液中含有的阴离子是Cl-、AlO2-
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积一定的密闭容器中,进行可逆反应A(g)+2B(g) ![]() C(g) +D(g),有图Ⅰ、Ⅱ所示的反应曲线,下列说法中不正确的是( )
C(g) +D(g),有图Ⅰ、Ⅱ所示的反应曲线,下列说法中不正确的是( )
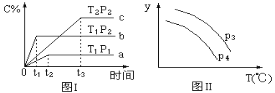
A. 正反应是放热反应
B. P1 <P2
C. 若P3<P4,y轴表示A的转化率
D. 若P3>P4,y轴表示C的体积分数
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物G是治疗高血压的药物“比索洛尔”的中间体,一种合成G的路线如下:

已知以下信息:
①A的核磁共振氢谱为单峰;B的核磁共振氢谱为三组峰,峰面积比为6∶1∶1。
②D的苯环上仅有两种不同化学环境的氢;1 mol D可与1 mol NaOH或2 mol Na反应。
回答下列问题:
(1)A的结构简式为____________。
(2)B的化学名称为____________。
(3)C与D反应生成E的化学方程式为_________________。
(4)由E生成F的反应类型为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图所示装置。

实验原理:Cu2S+O2![]() SO2 +2Cu,通过测定SO2的量来确定Cu2S的质量分数。实验时按如下步骤操作:
SO2 +2Cu,通过测定SO2的量来确定Cu2S的质量分数。实验时按如下步骤操作:
A.连接全部仪器,使其成为如图装置,并检查装置的气密性。
B.称取研细的辉铜矿样品1.000 g。
C.将称量好的样品小心地放入硬质玻璃管中。
D.以每分钟1 L的速率鼓入空气。
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为Cu2S+O2![]() SO2+2Cu。
SO2+2Cu。
F.移取25.00 mL含SO2的水溶液于250 mL锥形瓶中,用0.010 0 mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2~3次。
试回答下列问题:
(1)装置①的作用是______________;装置②的作用是____________。
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的离子方程式为___。
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是________。
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.04 | 21.03 |
2 | 25.00 | 1.98 | 21.99 |
3 | 25.00 | 3.20 | 21.24 |
(4)本方案设计中有一个明显的缺陷影响了测定结果(不属于操作失误),你认为是____________(写一种即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】宝鸡被誉为“青铜器之乡”,出土了大盂鼎、毛公鼎、散氏盘等五万余件青铜器。研究青铜器(含Cu、Sn等)在潮湿环境中发生的腐蚀对于文物保护和修复有重要意义。下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图,下列说法不正确的是( )
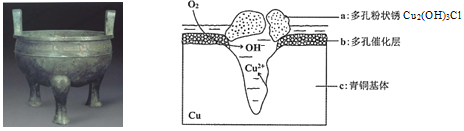
A. 青铜器发生电化学腐蚀,图中c作负极
B. 潮湿环境中Cl-浓度大有利于多孔粉状锈的生成
C. 若生成0.2 mol Cu2(OH)3Cl,则消耗的O2体积为4.48L
D. 环境中的Cl与正、负两极反应的产物作用生成a的离子方程式为2Cu2++3OH+Cl===Cu2 (OH)3Cl↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com