
科目: 来源: 题型:
【题目】造纸、炼焦、医药、塑料等行业的废水中常含有苯酚(C6H5OH),会对人类的生产和生活造成极大的危害。含酚废水的处理是环境科学领域的热点问题,下面介绍三项新技术。
电渗析
苯酚具有微弱的酸性,可利用电场促使C6H5O-定向移动、脱离废水,并富集回收。其电离方程式、电渗析装置示意图如下:


(1)为促进苯酚电离并增强溶液导电能力,可向废水中加入__________。
(2)A、B分别为离子交换膜,其中A应该是______(填“阳”或“阴”)离子交换膜。
催化重整制氢
在固定床反应器中,用含Rh催化剂使苯酚与水蒸气反应转化为氢气和二氧化碳。已知:2H2(g)+ O2(g)== 2H2O(g) ΔH1=-483.6 kJ·mol-1
C6H5OH(g)+ 7O2(g)== 6CO2(g)+ 3H2O(g) ΔH2=-2742.4 kJ·mol-1
(3)那么,反应C6H5OH(g)+ 11H2O(g)== 6CO2(g)+ 14H2(g) ΔH=_________kJ·mol-1。
活性炭纤维(ACF)物理吸附
ACF是一种活性炭纤维,不溶于水,具有多孔结构,可吸附苯酚等多种有机物质。下表是实验室里在不同温度下用0.50 g ACF吸附处理1 L苯酚溶液的相关数据。
T / ℃ | 25 | 35 | 45 | 55 | 65 |
起始苯酚浓度 / mol·L-1 | 1.50×10-3 | 1.50×10-3 | 1.50×10-3 | 1.50×10-3 | 1.50×10-3 |
平衡苯酚浓度 / mol·L-1 | 5.00×10-4 | 6.43×10-4 | 7.85×10-4 | 9.12×10-4 | 1.13×10-3 |
(4)由表格数据可知,C6H5OH(aq) + ACF(s) ![]() C6H5OH·ACF(s,吸附态) ΔH_____0(填“>”或“<”)。
C6H5OH·ACF(s,吸附态) ΔH_____0(填“>”或“<”)。
(span>5)已知:吸附平衡常数KF= ,(其中,平衡时单位质量吸附剂对苯酚的吸附量
,(其中,平衡时单位质量吸附剂对苯酚的吸附量![]() ;n为与ACF吸附能力相关的系数,25℃时n为0.5),计算25℃时KF(苯酚)=_____________________。
;n为与ACF吸附能力相关的系数,25℃时n为0.5),计算25℃时KF(苯酚)=_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】共价键都有键能之说,键能是指拆开1mol共价键所需要吸收的能量。如H-H键的键能是436kJ/mol,H—Cl键的键能是431kJ/mol,Cl—Cl键的键能是247 kJ /mol,H2和Cl2反应生成1molHCl放出的热量是( )
A.431kJB.179kJC.89.5kJD.以上说法都不对
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C均为短周期元素,它们在周期表中的位置如图。已知B、C两元素在周期表中族序数之和是A元素序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C所在的一组是( )

A.Be、Na、AlB.B、Mg、SiC.O、P、ClD.C、Al、P
查看答案和解析>>
科目: 来源: 题型:
【题目】全球气候变暖已经成为全世界人类面临的重大问题,研究CO2的利用对促进低碳社会的构建具有重要意义。

(1)利用“Na﹣CO 2”电池将CO 2变废为宝。我国科研人员研制出的可充电“Na﹣CO 2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO22Na2CO3+C.放电时该电池“吸入”CO 2,其工作原理如图一所示:
①放电时,正极产物全部以固体形式沉积在电极表面,正极的电极反应式为__________________。
②放电时,当转移0.1mol e-时,负极质量减少_____ g。
(2)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图二所示:
①上述生产过程的能量转化方式是____________________________________。
②上述电解反应在温度小于900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,则阳极放电的电极反应式为____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】I:现有以下几种物质①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸钠、⑥亚硫酸氢钠、⑦氨水。请回答下列问题:
(1)以上物质属于弱电解质的是______________(填序号);
(2)常温下④的溶液pH_____7(填“>”“<”或“=”),原因__________(用离子方程式表示);
(3)⑥的水溶液中呈酸性,原因是__________________________;
(4)常温下,将aL pH=11的NaOH溶液与bL pH=1的HNO3溶液混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a:b=________。
(5)已知:a.常温下,醋酸和NH3H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3═CH3COONa+CO2↑+H2O
则CH3COONH4溶液呈______性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈______性。
(6)对于醋酸溶液和醋酸钠溶液的下列说法正确的是____________;
A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小。
B.升高温度可以促进醋酸电离,也可以促进醋酸钠水解。
C.醋酸和醋酸钠混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离。
D.常温下,醋酸和醋酸钠等体积等浓度混合,溶液呈碱性。
II:25℃时,向盛有50mL pH=3的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。
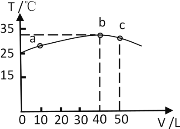
(7)由图可以推出HA溶液的物质的量浓度为_______________,25℃时,pH=3的HA溶液的电离度为______________。
(8)b点溶液中离子浓度由大到小的顺序为_______________________。
(9)加入NaOH溶液至溶液呈中性时出现在图中的位置_________(填“b点前” “b点”或“b点后”),溶液呈中性时,存在:c(A-)______c(Na+)(填“>”“<”或“=”)。
III:(10)已知:Ksp[Al(OH)3]=1×10-33, pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Al3+(使其浓度小于1×10-6 mol·L-1),需调节溶液pH范围为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁的实验流程如下,下列说法正确的是( )

A. MgCO3与稀硫酸反应的离子方程式为CO32-+2H+=CO2↑+H2O
B. 加入H2O2氧化的离子方程式为Fe2+ + H2O2+2H+ =Fe3+ + 2H2O
C. 滤渣2的成分是Fe(OH)3 和Mg(OH)2
D. 流程图中过滤与煅烧之间有一系列的的实验操作,最后得到MgSO4·7H2O晶体,对MgSO4·7H2O晶体直接加热可以得到无水MgSO4固体
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5mL稀盐酸。
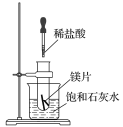
回答下列问题:
(1)实验中观察到的现象是________________。
(2)产生上述现象的原因是________________。
(3)写出有关反应的离子方程式____________。
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。

(1)X的转化率是______;
(2)由图中所给数据进行分析,该反应的化学方程式为______;
(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=__________;
(4)当反应进行到第____min,该反应是达到平衡。
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒温恒容的密闭容器中,充入2mol气体A和1mol气体B发生反应:
3A(g)+2B(g)![]() 2C(?)+4D(?)。反应一段时间后达到平衡,测得生成1.6molD,反应前后体系压强之比为5:3。则下列说法正确的是 ( )
2C(?)+4D(?)。反应一段时间后达到平衡,测得生成1.6molD,反应前后体系压强之比为5:3。则下列说法正确的是 ( )
A. 物质D一定是气体
B. 气体A的平衡转化率大于气体B的平衡转化率
C. 平衡后若减小该体系的压强,平衡向左移动,化学平衡常数减小
D. 平衡后升高温度,若平衡向右进行,则正反应的ΔH>0
查看答案和解析>>
科目: 来源: 题型:
【题目】AlPO4的沉淀溶解平衡曲线如图所示(T2>T1)。下列说法错误的是( )

A. AlPO4在b点对应的溶解度大于c点
B. AlPO4沉淀溶解是放热的过程
C. 图中四个点的Ksp:a=c=d<b
D. T1温度下,在饱和溶液中加入AlCl3可使溶液由c点变到a点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com