
科目: 来源: 题型:
【题目】近年来AIST报告正在研制一种“高容量、低成本”锂-铜空气燃料电池。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )

A. 放电时,Li+透过固体电解质向Cu极移动
B. 放电时,负极的电极反应式为Cu2O+H2O+2e-=2Cu+2OH-
C. 通空气时,铜被腐蚀,表面产生Cu2O
D. 整个反应过程中,铜相当于催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,将0.1000 mol·L-1盐酸滴入20.00 mL未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图所示,下列说法正确的是
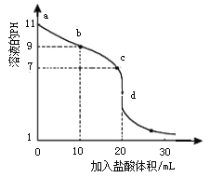
A. b点处的溶液中c(Cl-)>c(M+)>c(OH-)>c(H+)
B. 室温下,MOH的电离平衡常数Kb为1×10-5
C. c点处的溶液中c(M+)=c(Cl-)=c(H+)=c(OH-)
D. d点处的溶液中c(MOH) + c(H+) = c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】可以充分说明反应P(g)+Q(g)![]() R(g)+S(g)在恒温下已达到平衡的是
R(g)+S(g)在恒温下已达到平衡的是
A. 反应容器内的压强不随时间改变
B. 反应容器内P、Q、R、S四者共存
C. P的生成速率和S的生成速率相等
D. 反应容器内的气体总物质的量不随时间变化
查看答案和解析>>
科目: 来源: 题型:
【题目】含有某些含氧酸根杂质的粗KOH溶液可用电解法提纯,其工作原理如图所示。下列有关说法正确是

A. 装置右侧发生的电极反应式为:4OH- -4e- = 2H2O + O2↑
B. 通电后阴极区附近溶液pH会减小
C. m是电源负极
D. 纯净的KOH溶液从b出口导出
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:H2(g)+F2(g)===2HF(g) 的能量变化如图所示,下列有关叙述中正确的是

A.氟化氢气体分解生成氢气和氟气的反应是放热反应
B.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
D.断裂1 mol H—H键和1 mol F—F 键吸收的能量大于形成2 mol H—F键放出的能量
查看答案和解析>>
科目: 来源: 题型:
【题目】将等物质的量的A、B混合于2 L的密闭容器中,发生下列反应2A(g) + B(g) ![]() xC(g) + 2D(g),经4min后达平衡,测得D的浓度为1.0 mol·L-1,c(A) : c(B)=2 : 3,以C表示的平均速率υ(C)=0.125 mol·L-1·min-1,下列说法不正确的是
xC(g) + 2D(g),经4min后达平衡,测得D的浓度为1.0 mol·L-1,c(A) : c(B)=2 : 3,以C表示的平均速率υ(C)=0.125 mol·L-1·min-1,下列说法不正确的是
A. 反应速率υ(A)=0.25 mol·L-1·min-1
B. 该反应方程式中,x=1
C. 4 min时,B的物质的量为2 mol
D. 该反应的平衡常数K=1/3
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中进行反应:2A+3B![]() 2C。开始时C的浓度为amol·L-1,2min后C的浓度变为2amol·L-1,A和B的物质的量浓度均变为原来的1/2,则下列说法中不正确的是( )
2C。开始时C的浓度为amol·L-1,2min后C的浓度变为2amol·L-1,A和B的物质的量浓度均变为原来的1/2,则下列说法中不正确的是( )
A.用B表示的反应速率是0.75a mol/(L·min)
B.反应开始时,c(B)=3amol·L-1
C.反应2min后,c(A)=0.5amol·L-1
D.反应2min后,c(B)=1.5amol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为某学习兴趣小组对Cu与稀硝酸反应的改进实验装置图:

(1)按如图组装好仪器,检查气密性后,装药品,实验时,先关闭a,打开b,将装置B下移,使之与稀硝酸接触产生气体,当______(填实验现象),立刻将之上提,并关闭b,这样操作的目的为______。
(2)将铜丝下移,使之与稀硝酸接触,A中现象是______,稍后将铜丝上拉,使之与稀硝酸分离;打开a,挤压E,使少量空气进入A中,A中现象是______。
(3)打开b,交替挤压E和F,至装置内氮氧化物气体被氢氧化钠溶液充分吸收,写出NO2气体与氢氧化钠溶液充分反应的离子方程式:______。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,密闭容器中进行反应CH4(g) + H2O(g) ![]() CO(g) + 3H2(g),测得CH4的体积百分含量随温度和压强的变化如图所示。下列说法正确的是
CO(g) + 3H2(g),测得CH4的体积百分含量随温度和压强的变化如图所示。下列说法正确的是

A. p1>p2
B. ΔH<0
C. 加入催化剂可以提高甲烷的转化率
D. 恒温下,缩小容器体积,平衡后CH4浓度减小
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组设计实验探究CuSO4分解产物
Ⅰ.甲同学选择下列装置设计实验探究硫酸铜分解的气态产物SO3、SO2和O2,并验证SO2的还原性。

回答下列有关问题
(1)上述装置按气流从左至右排序为A、D、___________E、F(填代号)。
(2)装置D的作用是______________________;能证明有SO3生成的实验现象是______________________。
(3)在实验过程中C装置中红色溶液逐渐变为无色溶液,说明A中分解产物有___________;待C中有明显现象后,F开始收集气体,F装置中集气瓶收集到了少量气体,该气体是___________(填化学式)。
(4)为了验证SO2的还原性,取E装置中反应后的溶液于试管中,设计如下实验:
a.滴加少量的NH4SCN溶液 b.滴加少量的K3[Fe(CN)6]溶液
c.滴加酸性KMnO4溶液 d.滴加盐酸酸化的BaCl2溶液
其中,方案合理的有___________(填代号),写出E装置中可能发生反应的离子方程式:________________。
Ⅱ.乙同学利用A中残留固体验证固体产物(假设硫酸铜已完全分解)查阅资料知,铜有+2、+1价,且分解产物中不含0价的铜。Cu2O在酸性条件下不稳定,发生反应:Cu2O+2H+=Cu+Cu2++H2O。
(5)为了验证固体产物中是否有Cu2O,设计了下列4种方案,其中能达到实验目的的是___________。
甲:取少量残留固体于试管,滴加足量的稀硝酸,观察溶液颜色是否变为蓝色
乙:取少量残留固体于试管,滴加足量的稀硫酸,观察溶液颜色是否变为蓝色
丙:取少量残留固体于试管,滴加足量的稀盐酸,观察是否有红色固体生成
丁:取少量残留固体于试管,通入氢气,加热,观察是否生成红色固体
(6)经检验CuSO4分解生成CuO、Cu2O、SO3、SO2和O2,且CuO、Cu2O的质量之比为5:9,SO2、O2、SO3的体积之比(同温同压下测定)为4:3:2。写出CuSO4分解的化学方程式:______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com