
科目: 来源: 题型:
【题目】A、B、C、D、E均为短周期元素,原子序数依次增大,请根据表中信息回答下列问题:
元素 | 元素性质或结构 |
A | 最外层电子数是其内层电子数的2倍 |
B | B元素的单质在空气中含量最多 |
C | C元素在地壳中含量最多 |
D | D是同周期中原子半径最小的元素 |
E | E元素在同周期中金属性最强 |
F | F元素的最外层电子数等于周期序数 |
G | G元素原子M层上电子数比L上少2个电子。 |
(1)G在元素周期表中的位置________。
(2)B最简单气态氢化物的结构式____,属于____化合物(填“离子”或“共价”);E的最高价氧化物的水化物电子式____,所含化学键类型________。
(3)C、D、E、F、G简单离子半径由大到小顺序为:____(填离子符号)。
(4)用电子式表示G的氢化物的形成过程______。
(5)A元素的某氧化物与E元素的某含氧化合物反应生成单质的化学方程式是_______。
(6)E、F两元素最高价氧化物对应水化物相互反应的离子方程式:____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关滴定的说法正确的是( )
A. 用标准的KOH溶液滴定未知浓度的盐酸,配制标准溶液的固体KOH中混有NaOH杂质,则结果偏低。
B. 用C1mol/L酸性高锰酸钾溶液滴定V2mL未知浓度的H2C2O4溶液,至滴定终点用去酸性高锰酸钾溶液体积为V1mL,则H2C2O4溶液的浓度为![]() mol/L
mol/L
C. 用未知浓度的盐酸滴定已知浓度的NaOH溶液时,若读取读数时,滴定前仰视,滴定到终点后俯视,会导致测定结果偏低
D. 用25mL滴定管进行中和滴定时,用去标准液的体积为21.7mL
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差
B. 常温下2S2O(g)=3S(s)+SO2(g)能自发进行,可推断该反应为放热反应
C. 对于反应①C+CO2![]() 2CO(△H>0)和反应②N2+3H2
2CO(△H>0)和反应②N2+3H2![]() 2NH3(△H<0),达平衡后,升高温度,①反应速率加快,②反应速率减慢
2NH3(△H<0),达平衡后,升高温度,①反应速率加快,②反应速率减慢
D. NH4Cl和HCl溶于水后滴加石蕊都变红色,说明它们均能电离出H+
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物略去)。
![]()
(1)若A是一种黄色单质固体,则B→C的化学方程式为____。
(2)若A是一种活泼金属,C是淡黄色固体,则C的名称为____,试用化学方程式表示该物质与水的反应____。将C长期露置于空气中,最后将变成物质D,D的化学式为____。
(3)若C是红棕色气体,A是一种能使湿润的红色石蕊试纸变蓝的气体。请结合所学知识,写出实验室制取A的化学方程式____。
查看答案和解析>>
科目: 来源: 题型:
【题目】能正确解释下列反应原理,并且书写正确的离子方程式是
A. 用明矾作净水剂:Al3++3H2O=Al(OH)3↓+3H+
B. 用小苏打治疗胃酸过多:CO32-+2H+=CO2↑+H2O
C. 电解MgCl2饱和溶液制取Mg:MgCl2![]() Mg+Cl2↑
Mg+Cl2↑
D. 用碳酸钠溶液浸泡锅炉水垢:CaSO4+CO32-=CaCO3+SO42-
查看答案和解析>>
科目: 来源: 题型:
【题目】常见物质A~K之间存在如图所示的转化关系,其中A、D、E、H为单质,请回答下列问题。
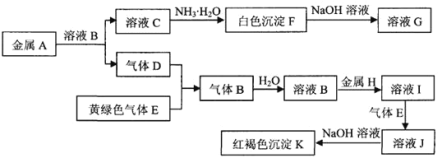
(1)下列物质的化学式是:C______,H______。
(2)反应“I→J”的离子方程式是____。
(3)检验J溶液中的金属离子的方法是(写出操作步骤、现象及结论)____。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应mA(s)+nB(g)![]() pC(g)△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )
pC(g)△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )
①m+n>p ②x点表示的正反应速率大于逆反应速率
③x点比y点时的反应速率慢 ④n>p
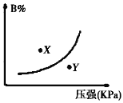
A. ①② B. ②④ C. ②③ D. ①③
查看答案和解析>>
科目: 来源: 题型:
【题目】下列表达式错误的是
A. 甲烷的电子式:![]()
B. 碳原子的L层电子轨道表示式:![]()
C. 硫离子的核外电子排布式:1s22s22p63s23p6
D. 碳-12原子:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)S8分子可形成单斜硫和斜方硫,转化过程如下:S(s,单斜)![]() S(s,斜方) ΔH=-0.398 kJ·mol-1,则S(单斜)、S(斜方)相比,较稳定的是______(填“S(单斜)”或“S(斜方)”)。
S(s,斜方) ΔH=-0.398 kJ·mol-1,则S(单斜)、S(斜方)相比,较稳定的是______(填“S(单斜)”或“S(斜方)”)。
(2)下表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1)
化学键 | H—H | H—Cl |
键能 | 436 | 431 |
热化学方程式:H2(g) + Cl2(g) = 2HCl(g) ΔH=-183 kJ·mol-1,则Cl2的键能为____kJ·mol-1。
(3)标准状况下,6.72LC2H2(g)在O2(g)中完全燃烧生成CO2(g)和H2O(l),放出389.7kJ热量,请写出表示C2H2燃烧热的热化学方程式:____________________________。
(4)已知:C(石墨,s)+ O2(g) = CO2(g) ΔH1=-a kJ·mol-1
H2(g) + 1/2O2(g) = H2O(l) ΔH2=-b kJ·mol-1
CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) ΔH3=-c kJ·mol-1
计算C(石墨,s)与H2(g)反应生成1 mol CH4(g)的ΔH为____kJ·mol-1 (用含a,b,c的式子表示)。
(5)由N2O和NO反应生成N2和NO2的能量变化如图所示。则反应过程中,每生成2 mol N2理论上放出的热量为__________。

查看答案和解析>>
科目: 来源: 题型:
【题目】化学兴趣小组用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
①称量1.0 g样品溶于水,配成250mL溶液;
②用碱式滴定管准确量取25.00mL所配溶液于锥形瓶中,滴加2~3滴酚酞溶液;
③用0.1000 mol·L-1的标准盐酸滴定并重复三次,每次实验数据记录如下:
滴定次数 | 待测液体积/mL | 所消耗盐酸标准溶液的体积/mL | |
滴定前 | 滴定后 | ||
1 | 25.00 | 1.50 | 21.40 |
2 | 25.00 | 2.50 | 22.60 |
3 | 25.00 | 0.60 | 23.20 |
(1)称量时,样品应放在________称量(选填字母序号)。
a.小烧杯中 b.洁净纸片上 c.托盘上
(2)如图是某次滴定时的滴定管中的液面,其读数为________mL。

(3)判断滴定终点到达时的现象为_______________________________。
(4)若出现下列情况,测定结果偏高的是________(选填字母序号)。
a.滴定前用蒸馏水冲洗锥形瓶
b.滴定过程中振荡锥形瓶时不慎将瓶内溶液溅出
c.滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管在滴定前有气泡,滴定后气泡消失
(5)通过计算可知该烧碱样品的纯度为________。(杂质不与酸反应)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com