
科目: 来源: 题型:
【题目】在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g)![]() 2C(g)+xD(g),5 s达到平衡。达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
2C(g)+xD(g),5 s达到平衡。达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
A. x=1B. B的转化率为20%
C. 平衡时A的浓度为1.50 mol·L-1D. B的平均反应速率为0.2 mol·L-1·s-1
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,H2R及其钠盐的混合溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH的变化关系如图所示。下列叙述错误的是

A. 由图可知:H2R的pKa1=1.3(已知:pKa= -lgKa)
B. 在pH=4.3的溶液中:3c(R2-) > c(Na+)
C. 0.2mol/L H2R溶液与0.3mol/L NaOH溶液等体积混合后的溶液中pH=4.3
D. 在pH=3的溶液中存在 ![]() =10-3
=10-3
查看答案和解析>>
科目: 来源: 题型:
【题目】秦皮是一种常用的中药,具有抗炎镇痛、抗肿瘤等作用。“秦皮素”是其含有的一种有效成分,结构简式如下图所示,有关其性质叙述不正确的是

A. 1mol 该化合物最多能与3 mol NaOH 反应 B. 该有机物分子式为C10H8O5
C. 该有机物能发生加成、氧化、取代等反应 D. 分子中有四种官能团
查看答案和解析>>
科目: 来源: 题型:
【题目】关于下列各装置图的叙述中,不正确的是

A. 用装置①精炼铜,则a极为电源正极,电解质溶液可为CuSO4溶液
B. 用湿润的淀粉-KI试纸检验装置②中阳极气体产物时,试纸变为蓝色
C. 装置③中钢闸门应与外接电源的负极相连,该保护法称为“牺牲阳极的阴极保护法”
D. 装置④中反应一段时间后,取Fe电极附近溶液滴加铁氰化钾溶液,不会产生蓝色沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料。下列说法一定正确的是( )
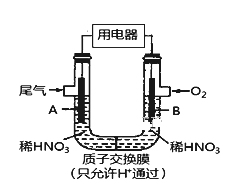
A. 该电池工作时,电子的流向外电路由A到B,内电路由B到A形成闭合回路
B. 电极B附近的HNO3浓度增大
C. A电极的反应为:NO2-e-+H2O==NO3-+2H+ NO-3e-+2H2O===NO3-+4H+
D. 该电池工作时,每消耗11.2LO2(标准状况下),可以除去含1molNO和NO2的混合尾气
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组利用如下装置制备Cu(NH3)xSO4·H2O(溶于水呈深蓝色).并测量x值。

(Cu(NH3)xSO4·H2O制备)见图1
(1)A中发生的化学反应方程式为_____________________________ 。
(2)B中观察到的现象是_______________________;C中CCl4的作用是 ______________。
(3)欲从Cu(NH3)xSO4溶液中析出Cu(NH3)xSO4·H2O晶体,可加入试剂 _______________ 。
(x值的测量)见图2
步骤一:检查装置气密性,称取0.4690g晶体[M = (178+17x)g/mol]于锥形瓶a中;
步骤二:通过分液漏斗向锥形瓶a中滴加l0%NaOH溶液;
步骤三:用0. 5000 mol/L的NaOH标液滴定b中剩余HCI,消耗标液16. 00 mL。
(4)步骤二的反应可理解为Cu(NH3)xSO4与NaOH在溶液中反应,其离子方程式为 ______。
(x值的计算与论证)
(5)计算:x = __________ ,
该学习小组针对上述实验步骤,提出测量值(x)比理论值偏小的原因如下:
假设1:步骤一中用于称量的天平砝码腐蚀缺损;
假设2:步骤二中 _______________________________________________(任写两点);
假设3 :步骤三中测定结束读数时,体积读数偏小。该假设_____(填“成立”或“不成立”)。
(6)针对假设l,你对实验的处理意见是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:2FeSO4![]() Fe2O3+SO2↑+SO3↑,利用下图所示装置检验硫酸亚铁的分解产物(乙、丙、丁中的试剂是足量的)。下列说法中不正确的是
Fe2O3+SO2↑+SO3↑,利用下图所示装置检验硫酸亚铁的分解产物(乙、丙、丁中的试剂是足量的)。下列说法中不正确的是

A. 乙、丙、丁中依次盛装的试剂可以是BaCl2溶液、品红溶液、NaOH溶液
B. 实验开始时,先打开K1和K2,缓缓通入N2一段时间,再点燃酒精喷灯加热
C. 若丙中盛装的是酸性KMnO4溶液检验SO2气体时,则SO2表现出还原性
D. 为了检验甲中残留固体中含有Fe3+,取少量固体加入稀硝酸溶解,再滴加KSCN溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应方程式为:[Cu(NH3)2]OOCCH3+CO+NH3=[Cu(NH3)3(CO)]OOCCH3。
请回答下列问题:
(1)C、N、O的电负性由大到小的顺序为_________________,基态Fe原子的价电子排布图为________________。
(2)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是__________,与CO互为等电子体的分子的电子式为_________________。
(3)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型是_____________,配体中提供孤对电子的原子是___________________________________。
(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有_______________形成。
a.离子键 b.配位键 c.非极性键 d.б键
(5)NaAlH4晶体的晶胞如图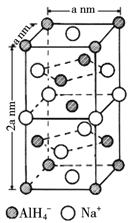 ,与Na+紧邻且等距的AlH4-有___________个;NaAlH4晶体的密度为_________g·cm-3(用含a的代数式表示)。
,与Na+紧邻且等距的AlH4-有___________个;NaAlH4晶体的密度为_________g·cm-3(用含a的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】探究Mg(OH)2的溶解平衡时,利用下表三种试剂进行试验,下列说法中不正确的是
编号 | ① | ② | ③ |
分散质 | Mg(OH)2 | HCl | NH4Cl |
备注 | 悬浊液 | 1 mol/L | 1 mol/L |
A. 向①中滴入几滴酚酞试液后,溶液显红色说明Mg(OH)2是一种弱电解质
B. 为了使Mg(OH)2悬浊液溶解得更快,加入过量的NH4Cl浓溶液并充分振荡,效果更好
C. ①、③混合后发生反应:Mg(OH)2(s)+2NH4+(aq)![]() Mg2+(aq)+2NH3·H2O(aq)
Mg2+(aq)+2NH3·H2O(aq)
D. 向①中加入②,H+与OH—反应生成H2O,使c(OH-)减小,Mg(OH)2溶解平衡向溶解方向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、D、E、F均为短周期元素(原子序数B<A<F<E<D)。25℃时,其最高价氧化物的水化物(设浓度均为0.001mol/L)溶液的pH和原子半径的关系如图所示。下列说法中正确的是

A. A和F的简单离子半径大小顺序:A < F
B. 上述五种元素中有两种元素是金属元素
C. D的最高价氧化物水化物的化学式为HDO3
D. D、E的气态氢化物的稳定性:D > E
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com