
科目: 来源: 题型:
【题目】某科研人员提出HCHO(甲醛)与O2在羟基磷灰石(HAP)表面催化生成H2O的历程,该历程示意图如下(图中只画出了 HAP的部分结构):
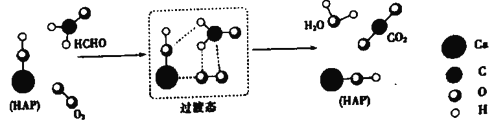
下列说法不正确的是
A. HAP能提高HCHO与O2的反应速率
B. HCHO在反应过程中,有C-H键发生断裂
C. 根据图示信息,CO2分子中的氧原子全部来自O2
D. 该反应可表示为:HCHO+O2![]() CO2+H2O
CO2+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】肉桂酸甲酯M常用作调制具有草莓、葡萄、樱桃等香味的食用香精。M属于芳香化合物,苯环上只含一个直支链,能发生加聚反应和水解反应。测得M的摩尔质量为162 g·mol-1,只含碳、氢、氧三种元素,且原子个数之比为5∶5∶1。
(1)肉桂酸甲酯的结构简式是___________________________。
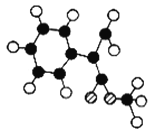
(2)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如图所示(图中球与球之间连线表示单链或双键)。G的结构简式为_____________。
(3)以芳香烃A为原料合成G的路线如下:
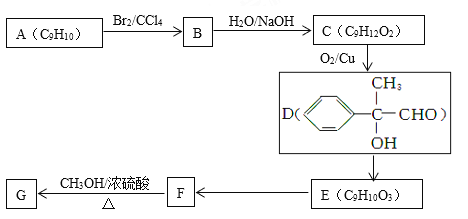
①化合物E中的含氧官能团有_____________(填名称)。
②E→F的反应类型是__________,F→G的化学方程式为______________________。
③符合下列条件的F的同分异构体中:
Ⅰ.分子内含苯环,且苯环上只有一个支链;不含“―O―O―”和“―C≡C―”;
Ⅱ.在催化剂作用下,1 mol该物质与足量氢气充分反应,消耗5 mol H2;
Ⅲ.它不能发生水解反应,不能发生酯化反应。
其中能与银氨溶液反应,且1mol该有机物与析出的银的物质的量之比为1∶4的是_________________________________(写结构简式);其中核磁共振氢谱图中有6个峰,且峰面积之比为1∶1∶1∶1∶2∶2的是 _________________________(写结构简式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】四氯化锡可用作媒染剂。利用如图所示装置可以制备四氯化锡(部分夹持装置已略去);

有关信息如下表:
化学式 | SnCl2 | SnCl4 |
熔点/℃ | 246 | -33 |
沸点/℃ | 652 | 144 |
其他性质 | 无色晶体,易氧化 | 无色液体,易水解 |
回答下列问题:
(1)戊装置中冷凝管的进水口为___________(填“a”或“b”)。
(2)用甲装置制氯气,MnO4-被还原为Mn2+,该反应的离子方程式为________________________。
(3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到___________(填现象)后,开始加热丁装置,锡熔化后适当增大氯气流量,继续加热丁装置,此时继续加热丁装置的目的是:①促进氯气与锡反应;②_______________________________。
(4)如果缺少乙装置,可能产生的后果是___________________;己装置的作用是__________________。
(5)某同学认为丁装置中的反应可能产生SnCl2杂质,以下试剂中可用于检测是否产生SnCl2 的有_______________(填标号)。
a.FeCl3溶液(滴有KSCN) b.H2O2溶液 C.溴水 d.AgNO3溶液
(6)反应中用去锡粒1.19g,反应后在戊装置的试管中收集到2.38 gSnCl4,则SnCl4的产率为____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有A、B、C、D、E、F、G、H八种元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B元素是形成化合物种类最多的元素 |
C元素基态原子的核外p电子数比s电子数少1 |
D元素基态原子的核外p轨道中有两个未成对电子 |
E元素的气态基态原子的第一至第四电离能分别是: I1=738kJ/mol,I2 = 1451 kJ/mol,I3 = 7733kJ/mol,I4 = 10540kJ/mol |
F元素的主族序数与周期数的差为4 |
G元素是前四周期中电负性最小的元素 |
H元素位于元素周期表中的第八列 |
(1)C2A4的电子式为______________。(A、C为字母代号,请将字母代号用元素符号表示,下同)
(2)B元素的原子核外共有______种不同运动状态的电子,基态原子中能量最高的电子所占据的原子轨道呈_______形。
(3)某同学推断E元素基态原子的核外电子排布图为:![]() 。该同学所画的电子排布图违背了________________,该元素的原子I3远远大于I2,其原因是__________________________________。
。该同学所画的电子排布图违背了________________,该元素的原子I3远远大于I2,其原因是__________________________________。
(4)D、E、F三种元素的简单离子半径由大到小的顺序是_______________。(用离子符号表示)
(5)用惰性电极电解EF2的水溶液的离子方程式为_____________________________。
(6)H位于元素周期表中_______区(按电子排布分区),其基态原子的价电子排布式为_________,实验室用一种黄色溶液检验H2+时产生蓝色沉淀,该反应的离子方程式为__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】羰基硫(COS)是全球硫循环的重要中间体,也是有机合成中的重要原料,是化学工作者重要的研究对象。已知:
Ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g) △Hl=-17kJ/mol;
H2S(g)+CO(g) △Hl=-17kJ/mol;
Ⅱ.COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H2=-35kJ/mol。
H2S(g)+CO2(g) △H2=-35kJ/mol。
回答下列问题:
(1)反应CO(g)+H2O(g)![]() H2(g)+CO2(g)的△H=________。
H2(g)+CO2(g)的△H=________。

(2)在充有催化剂的恒压密闭容器中进行反应I。设起始充入的n(COS):n(H2)=m,相同时间内测得COS转化率与m和温度(T)的关系如图所示。
①m1________m2(填>、<或=)。
②温度高于T0时,COS转化率减小的可能原因为_________。
A.有副反应发生。 B.反应的△H增大。
C.催化剂活性降低。 D.逆反应速率增大的倍数大于正反应速率增大的倍数
(3)在恒温、恒容密闭容器中.进行反应I。下列说法中能说明反应I已达到平衡状态的是____。
A.c(H2S)=c(CO) B.v正(H2)=v逆(H2S)
C.容器中气体密度保持不变 D.容器中混合气体平均摩尔质量保持不变
E.c(COS)保持不变
(4)某温度下,向体积为2 L的恒容密闭容器中通入5 mol COS(g)和5 molH2O(g),发生反应Ⅱ,5 min后反应达到平衡,测得COS(g)的转化率为60%。
①反应从起始至5 min内,用H2S浓度变化表示的平均反应速度v(H2S)=________。
②该温度下,上述反应的平衡常数K=________。
③其他条件相同时,既能使上述反应中COS的平衡转化率增大,又能使反应速率加快的做法是________。
A.缩小容器容积 B.升高温度
C.分离出硫化氢 D.加入一定量H2O(g)
查看答案和解析>>
科目: 来源: 题型:
【题目】随着人们的物质生活水平的不断提高和工业化快速发展,环境污染也日益加重,空气中有毒气体主要包括SO2、CO、NOx、烃类等等。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和水。已知CH4和S的燃烧热ΔH分别为-890 kJ/mol和-297kJ/mol,则CH4和SO2反应的热化学方程式为_________________________________________。
(2)在20 L的密闭容器中按物质的量之比1∶2充入CO和H2,发生反应:CO(g)+2H2(g)![]() CH3OH(g) ΔH。测得CO的转化率随温度及不同压强的变化如图所示,P2和195 ℃时n(H2)随时间的变化结果如表所示。
CH3OH(g) ΔH。测得CO的转化率随温度及不同压强的变化如图所示,P2和195 ℃时n(H2)随时间的变化结果如表所示。
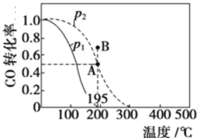
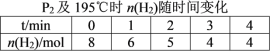
①P2及195℃下,在B点时,v(正)_____v(逆)(填“>”、“<”或“=”)。
②该反应的ΔH_________0(填“>”、“<”或“=”),原因是______________________________。
③在0~2 min,平均反应速率v(CH3OH)=______________________。(数值用小数形式表示)
④在P2及195 ℃时,该反应的平衡常数Kp=__________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,结果用含P2的分式表示)。
(3)某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见图所示。
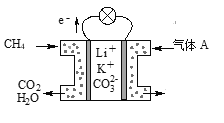
①气体A中除了O2外,一定还含有的气体是________。
②该电池的负极反应式为__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸(H2C2O4)是一种易溶于水的二元中强酸,KHC2O4溶液显酸性。现称取5.0g含H2C2O42H2O、KHC2O4和K2SO4的固体样品,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。第一份溶液中加入2滴酚酞试液,滴加0.2500mol/LNaOH溶液,滴定终点时消耗NaOH溶液16.00mL。第二份溶液用0.1000mol/L酸性KMnO4溶液滴定,当加入12.00mL酸性KMnO4溶液时恰好反应完全。
(1)K2C2O4溶液呈碱性的原因(用离子方程式表示)_______________________________。
(2)在该实验中不需要用到的实验仪器有___________(填字母编号)。
A.容量瓶 B.酸式滴定管 C.碱式滴定管 D.分液漏斗 E.锥形瓶 F.圆底烧瓶
(3)第一份用NaOH溶液滴定时,滴定终点的判断依据为____________________________________。
(4)原试样中KHC2O4的质量分数为__________%(保留3位有效数字)。
(5)如果用0.2500mol/LNaOH溶液滴定第一份溶液的实验中,在滴定终点时俯视读数。则测得的KHC2O4的质量分数_________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,四种溶液的pH如下:
① | ② | ③ | ④ | |
pH | 3 | 3 | 11 | 11 |
溶液 | 盐酸 | 醋酸 | NaOH溶液 | 氨水 |
(1)③的溶液中由水电离出c(H+)水·c(OH-)水=______________(mol/L)2。
(2)②中加入少量醋酸钠晶体后,溶液的pH________。(填“增大”、“减小”或“不变”)
(3)②和③两溶液等体积混合,所得溶液中c(Na+)______c(CH3COO-)(填“>”、“<”或“=”)。
(4)若一定体积的①和④恰好完全反应生成氯化铵溶液,该溶液中离子浓度由大到小的顺序是_________________________________。
(5)25℃时,a mol/L醋酸溶液与b mol/LNaOH溶液等体积混合后pH=7,则醋酸的电离常数Ka=__________。(用含a、b的代数式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:

(1)浸锰过程中Fe2O3与SO2反应的化学方程式为Fe2O3+ SO2+2H+=2Fe2++ SO42-+ H2O,该反应是经历以下两步反应实现的。写出ⅱ的离子方程式:_____________。
ⅰ:Fe2O3 + 6H+ = 2Fe3++3H2O
ⅱ:……
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为_____________(填离子符号)。
(3)写出氧化过程中MnO2与SO2反应的化学方程式:_________________。
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是_________;向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是___________________。

(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:___________________。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素A、B、C、D、E、F的原子序数依次增大,A和B形成的气态化合物的水溶液呈碱性,A和D同主族,B和C相邻,F的最高价氧化物对应的水化物为无机含氧酸中的最强酸。E与B可组成化合物E3B2,且该物质遇水发生水解反应。已知利用如下图所示装置以制备E3B2,装置①用于制备B单质。

下列说法正确的是
A. E与B的简单离子的电子层结构相同,且简单离子半径B<E
B. ④⑥中依次盛装的试剂可以是NaOH溶液、碱石灰
C. D元素形成的单质与A2C不反应
D. 实验结束后,取⑤中的少量产物于试管中,加适量蒸馏水,可以产生使试管口湿润的红色石蕊试纸变蓝的气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com