
科目: 来源: 题型:
【题目】α-氰基烯酸酯类医用胶无毒无害、性质稳定、与生物组织粘合好,可用做手术伤口粘合剂。其分子结构可用如图所示的通式表示:

资料卡片:
①分子中 “—R1”部分碳链适当增长,有助于延长固化时间。
②分子中 “-R2”部分碳链增长,耐水性增强,更适合在水湿环境中粘合。
③分子中 “-R2”部分若再引入一个α-氰基烯酸酯的结构,则可发生交联聚合,使胶膜硬度、韧性均增强。
(1)502胶是应用最早的医用胶,主要成分是![]() 。
。
① 该分子中含有的官能团是氰基(—CN)、碳碳双键和_______。
② 该物质具有粘合性的原因是发生加聚反应(微量水蒸气作用下),化学方程式是_______。
③ 常温下,丙烯难以聚合,而502胶可以快速聚合。从分子结构的角度分析产生该差异的原因是_______。
(2)科学家已将502胶改良为504胶(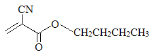 ),504胶相对502胶的优点是_______。
),504胶相对502胶的优点是_______。
(3)用于粘接骨骼的“接骨胶”固化时间不能太短,且粘合后强度要高。请设计一种 “接骨胶”,写出其主要成分的结构简式:_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型,高效、多功能绿色水处理剂,可通过KClO溶液与Fe(NO3)3溶液的反应制备。
已知:①KClO在较高温度下发生歧化反应生成KClO3
②K2FeO4具有下列性质:可溶于水、微溶于浓KOH溶液;在强碱性溶液中比较稳定;在Fe3+催化作用下发生分解,在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2,如图所示是实验室模拟工业制备KClO溶液装置。

(1)B装置的作用为______________________;
(2)反应时需将C装置置于冷水浴中,其原因为__________________;
(3)制备K2FeO4时,不能将碱性的KClO溶液滴加到Fe(NO3)3饱和溶液中,其原因是________,制备K2FeO4的离子方程式_________________;
(4)工业上常用废铁屑为原料制备Fe(NO3)3溶液,溶液中可能含有Fe2+,检验Fe2+所需试剂名称________,其反应原理为______________________(用离子方程式表示);
(5)向反应后的三颈瓶中加入饱和KOH溶液,析出K2FeO4固体,过滤、洗涤、干燥。洗涤操作所用最佳试剂为______________________;
A.水 B.无水乙醇 C.稀KOH溶液
(6)工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解1.00g K2FeO4样品,调节pH使高铁酸根全部被还原成亚铁离子,再调节pH为3~4,用1.0mol/L的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),淀粉作指示剂,装有Na2S2O3标准溶液的滴定管起始和终点读数如如图所示:

①消耗Na2S2O3标准溶液的体积为____________mL。
②原样品中高铁酸钾的质量分数为_________________。[M(K2FeO4)=198g/mol]
③若在配制Na2S2O3标准溶液的过程中定容时俯视刻度线,则导致所测高铁酸钾的质量分数____________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法省略,检验其他阴离子的过程如下图所示。

(1)图中试剂①~⑤溶质的化学式分别是:
①________,②________,③________,④__________,⑤__________。
(2)图中现象c表明检验出的离子是________________。
(3)白色沉淀A若加试剂③而不加试剂②,对实验的影响是____________________。
(4)气体E通入试剂④发生反应的离子方程式是_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于下列实验现象的解释,不合理的是
实验 | 现象 | 解释 | |
A | | ②中产生气体的速率比①慢 | 乙醇分子中,乙基对羟基产生影响,使O—H键不容易断裂 |
B |
| ③中振荡静置后分层,上层为橙色;④中产生白色沉淀 | 苯酚分子中,苯环对羟基产生影响,使O—H键更容易被取代 |
C |
| ⑤中振荡静置后分层,下层为紫色溶液;⑥中振荡后紫色溶液褪色 | 甲苯分子中,苯环对甲基产生影响,使甲基上C—H更容易被氧化 |
D |
| 水浴加热,⑦中未见明显变化;⑧中试管壁上附着一层光亮的银 | 碱性条件下+1价的Ag才能氧化乙醛 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛。SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生。实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示。


(1)实验室制取SOCl2在三颈烧瓶中进行,整个装置所选仪器的连接顺序是⑥→___→①;___→②(已知①处通入Cl2、除杂装置可以重复使用)。
(2)冷凝管上连接的干燥管的作用是:①尾气处理;②___。
(3)实验室制Cl2的离子方程式为___。
(4)该实验中制取SO2,下列最适宜的试剂是___(填下列字母编号)。
A.Cu固体与18.4molL-1硫酸
B.Na2SO3固体与20%硫酸
C.Na2SO3固体与70%硫酸
D.Na2SO3固体与18.4molL-1硫酸
(5)预测SOCl2遇水反应的化学方程式为___。
(6)取少量的SOCl2加入足量NaOH溶液,振荡、静置得到无色溶液,检验溶液中存在Cl-的试剂有____。
查看答案和解析>>
科目: 来源: 题型:
【题目】近年我国某些城市酸雨污染较为严重,主要是因为大量燃烧含硫量高的煤而形成的。
实验目的:通过实验证明煤中含有碳元素和硫元素。
查阅资料:
(1)“二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色),请完成该反应的离子方程式:___。
( )SO2+( )MnO4-+( )=( )+( )Mn2++( )
根据上述资料,甲同学和丙同学分别设计实验方案进行探究。
实验探究:甲同学:甲同学进行了如图所示A、B两步实验:

“实验现象”:A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊。
“得出结论”:煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素。
(2)乙同学认为甲的方案不合理,其理由是___:
实验探究:丙同学:丙同学进行了如图所示实验(部分装置在图中略去):

(3)图C装置的作用是___。
(4)证明煤中含有碳元素和硫元素的现象是:___。
(5)装置C中的高锰酸钾溶液也可以替换为___。
A.足量I2的淀粉溶液
B.足量饱和NaHCO3溶液
C.足量Na2SO3溶液
D.足量溴水
查看答案和解析>>
科目: 来源: 题型:
【题目】向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A. Cu与Cu2O的物质的量之比为2∶1 B. 硝酸的物质的量浓度为2.6mol/L
C. 产生的NO在标准状况下的体积为4.48L D. Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
查看答案和解析>>
科目: 来源: 题型:
【题目】凯夫拉纤维是生产防弹衣的主要材料之一,其结构片段如下:

下列说法不正确的是
A. 其结构简式为:![]()
B. 凯夫拉纤维在发生水解反应的过程中,![]() 中的C—N键断裂
中的C—N键断裂
C. 完全水解产物的单个分子中,苯环上的氢原子具有相同的化学环境
D. 通过质谱法测定凯夫拉纤维的平均相对分子质量,可得其聚合度
查看答案和解析>>
科目: 来源: 题型:
【题目】现有含Fe(NO3)3、Cu(NO3)2、HNO3的某稀溶液,若向其中逐步加入铁粉,溶液中Fe2+浓度与加入铁粉的物质的量之间的关系如右图所示,则该溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )

A. 1∶1∶3B. 1∶2∶4C. 1∶1∶4D. 1∶3∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com