
科目: 来源: 题型:
【题目】某化学兴趣小组用如图所示装置探究苯与溴的反应原理。

请回答下列问题:
(1) 仪器M的名称为__________。
(2) 装置Ⅰ中铁丝除做催化剂外,还可控制反应的进行,使反应停止的操作是__________。
(3)装置Ⅰ中生成溴苯的化学方程式为______________________________。
(4)冷凝管的进水口为________((填“a”或“b”),下同;其作用是_____________;
(5)能验证苯与液溴发生的是取代反应的现象是______________;
(6)装置Ⅱ中,若撤去装有苯的小试管,将导管直接插入硝酸银溶液,对实验目的达成会产生什么影响__________________________
(7)装置III中的离子反应方程式为_______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知有机物分子中的碳碳双键发生臭氧氧化反应: ,有机物A的结构简式为
,有机物A的结构简式为 ,G的分子式为C7H12O,以下A~H均为有机物,其转化关系如下:
,G的分子式为C7H12O,以下A~H均为有机物,其转化关系如下:

(1)下列说法正确的是 ______ 。(填字母序号)
A.C的官能团为羧基
B.1molA最多可以和2molNaOH反应
C.C可以发生氧化反应、取代反应和加成反应
D.![]() 可以发生消去反应
可以发生消去反应
(2)F的结构简式为____________ ,由F到G的反应类型为___________ 。
(3)反应①的作用是__________________ ,合适的试剂a为____________。
(4)同时满足下列条件的A的一种同分异构体的结构简式______________________。
Ⅰ.与A具有相同的官能团;Ⅱ.属于苯的邻二取代物;Ⅲ.能使FeCl3溶液显色;Ⅳ.核磁共振氢谱分析,分子中有8种不同化学环境的氢原子。
(5)H与G分子具有相同的碳原子数目,且1molH能与足量的新制银氨溶液反应生成4mol单质银。写出H与足量的新制银氨溶液反应的化学方程式__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铝及其化合物在生活、生产中有广泛应用。
(1)Na3AlF6是冰晶石的主要成分,冰晶石常作工业冶炼铝的助熔剂。工业上,用HF、Na2CO3和Al(OH)3制备冰晶石。化学反应原理是,2Al(OH)3+3Na2CO3+12H=2Na3AlF6+3CO2↑+9H2O.属于盐的有Na2CO3和_______。上述反应不能在玻璃容器中反应,其原因是________(用化学方程式表示)。
(2)明矾[KAl(SO4)2·12H2O]常作净水剂。在明矾溶液中滴加氢氧化钡溶液至Al3+恰好完全沉淀,写出该反应的离子方程式____________。
(3)铝合金广泛用于建筑材料。等质量的铁、铝、硅组成的同种合金分别与足量盐酸、足量烧碱溶液反应,产生氢气体积相等(同温同压)。则该合金中铁、硅的质量之比为______。(已知:Si+2NaOH+H2O=Na2SiO3+ 2H2↑)
(4)铝氢化钠(NaAlH4)是有机合成的重要还原剂。它的制备方法是将氢化钠和氯化铝在乙醚中反应制备铝氢化钠。
①写出化学方程式________________。
②在化学上,含氢还原剂的还原能力用“有效氢”表示,”有效氢”含义是单位质量的含氢还原剂的还原能力相当于多少克氢气。一般地含氢还原剂的氢被氧化成H2O,“还原能力”用氢失去电子数多少表示。NaAlH4、NaH的“有效氢”之比为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在2L容器中3种物质间进行反应,X,Y,Z的物质的量随时间的变化曲线如图,反应在t1 min时到达平衡,如图所示:

(1)该反应的化学方程式是_________。
(2)①若上述反应中X,Y,Z分别为NH3、H2、N2 , 且已知1mol 氨气分解成氮气和氢气要吸收46kJ的热量,则至t1 min时,该反应吸收的热量为_______;在此t1 min时间内,用H2表示反应的平均速率v(H2)为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间的转化关系如图所示。已知:淀粉遇单质碘变蓝。下列说法中,不正确的是
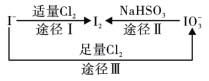
A. 氧化性的强弱顺序为:Cl2 >IO3- >I2
B. 一定条件下, I-与IO3-反应可能生成I2
C. 途径Ⅱ中若生成1mol I2,消耗4mol NaHSO3
D. 向含I-的溶液中通入Cl2,所得溶液加入淀粉溶液不一定变为蓝色
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示是一个制取Cl2并以Cl2为原料进行特定反应的装置,多余的Cl2可以贮存在b瓶中,其中各试剂瓶中所装试剂为:B(氢硫酸)、C(淀粉KI溶液)、D(水)、F(紫色石蕊试液)。

(1)若装置A烧瓶中的固体为MnO2,液体为浓盐酸,则其发生反应的化学方程式为____________________________________________________。
(2)装置E中硬质玻璃管内盛有炭粉,若E中发生氧化还原反应,其产物为二氧化碳和氯化氢,写出E中反应的化学方程式:_________________________________________。
(3)D中溶液的存在含氯的阴离子为___________________________。
(4)在F中紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是__________________________。
(5)若F中盛有NaOH溶液,其作用是_____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上制备铝一般是从铝土矿(主要成分是Al2O3,含有Fe2O3杂质)中得到纯净的Al2O3,然后电解Al2O3得到铝。下图是从铝土矿中提纯Al2O3的简单示意图。其中涉及到的一个反应:2NaAlO2+CO2+3H2O=Na2CO3+2Al(OH)3↓。

(1)图示中实验操作(1)是________;加入的试剂②是__________(填化学式)
(2)试写出B溶液中的溶质的化学式:_____________
(3)写出化学方程式:
①铝土矿→A:_________________________________________________。
②E→F:_______________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】把VL含有![]() 和
和![]() 的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使铁离子完全沉淀为氢氧化镁;另一份加入含
的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使铁离子完全沉淀为氢氧化镁;另一份加入含![]() 溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的物质的量浓度是( )
溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的物质的量浓度是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】T℃时,向2L恒容密闭容器中充入1mol NO2与2mol SO2发生如下反应:NO2(g)+SO2(g) ![]() SO3(g)+NO(g)△H=﹣41.8kJ/mol。
SO3(g)+NO(g)△H=﹣41.8kJ/mol。
(1)下列能说明该反应达到平衡状态的是_____________。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗n mol SO3的同时生成n mol NO2
(2)反应进行到20s 时,测得反应速率v(NO)=0.005mol/(Ls) , 则消耗的NO2为_____mol。
(3)下列措施能使反应加快的是___(仅改变一个条件)
a.降低温度 b.缩小容积 c.使用效率更高的催化剂
(4)若上述容器为绝热容器(与外界无热交换),则到达平衡所需时间将__________。
a.延长 b.缩短 c.不变 d.无法确定
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验方案或说法正确的是
A.  实验室制取乙酸乙酯
实验室制取乙酸乙酯
B.  比较NaHCO3和Na2CO3的热稳定性
比较NaHCO3和Na2CO3的热稳定性
C.  脱脂棉燃烧证明过氧化钠与水反应放热
脱脂棉燃烧证明过氧化钠与水反应放热
D.  a处有红色物质生成,b处变蓝,证明X一定是H2
a处有红色物质生成,b处变蓝,证明X一定是H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com