
科目: 来源: 题型:
【题目】消除含氮、硫等化合物的污染对建设美丽家乡,打造宜居环境具有重要意义。
I.用NH3催化还原NOx可以消除氮氧化物的污染,NOx若以NO为例,在恒容容器中进行反应:4NH3(g)+6NO(g) ![]() 5N2(g)+6H2O(g) ΔH<0。
5N2(g)+6H2O(g) ΔH<0。
(1)以下选项可以判断反应达到平衡状态的是_______。
A..4v正(NH3)=5v逆(N2) B.反应体系中气体密度不变
C..反应体系中气体压强不变 D.反应体系中气体平均摩尔质量不变
(2)图I中曲线表示转化率与反应时间的关系。若改变起始条件,使反应过程由a状态转为b状态进行,可采取的措施是_______

A.降低温度 B.增大反应物中NO的浓度
C.加催化剂 D.向密闭容器中通入氩气
II.燃煤烟气中含有大量SO2和NO。某科研小组研究臭氧氧化的碱吸收法同时脱除SO2和NO工艺,反应进程如图II所示。
反应1:NO(g)+O3(g)![]() NO2(g)+O2(g)
NO2(g)+O2(g)
反应2:SO2(g)+O3(g)![]() SO3(g)+O2(g)
SO3(g)+O2(g)

已知该体系中温度80℃以上臭氧发生分解反应:2O3![]() 3O2。且100℃时臭氧的分解率约为10%。请回答:
3O2。且100℃时臭氧的分解率约为10%。请回答:
(1)写出反应1的热化学方程式_______,反应1在高温下不能自发进行,则该反应的熵变ΔS_______0(填“大于”或“小于”)。
(2)其他条件不变,向五个体积固定为1L的密闭容器中均充入含1.0 mol NO、1.0 mol SO2的模拟烟气和2.0mol O3,在不同温度下反应相同时间后体系中NO和SO2的转化率如图所示:

①若P、Q两点为非平衡点,试分析P点转化率大于Q点的可能原因_______。100℃,t秒时反应1进行到P点,反应从开始到t秒时NO的平均速率v(NO)=_______mol·L1·s1(用含t的式子表示)。
②若Q点为平衡点,100℃下反应2的平衡常数的数值约为_______(精确到0.01)。
查看答案和解析>>
科目: 来源: 题型:
【题目】含氮化合物与生产、生活、生命和环境息息相关。
(1)NO加速臭氧层被破坏,其反应过程如图所示。
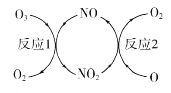
①NO的作用是________________________。
②已知:O3(g)+O(g) =2O2(g) △H=-143kJ·mol-1
反应l:O3(g)+NO(g) =NO2(g)+O2(g)△H1=-200.2kJ·mol-1
则反应2的热化学方程式为____________________________。
(2)肌红蛋白(Mb)是肌肉内储存氧的蛋白质,构成肌红蛋白的甘氨酸(H2NCH2COOH)是一种两性物质,在溶液中以三种离子形式存在,其转化关系如下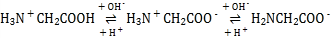 三种离子的物质的量分数(δ)与[
三种离子的物质的量分数(δ)与[![]() ]的关系如图所示。
]的关系如图所示。
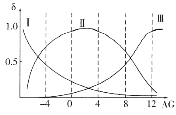
①溶液呈中性时,三种离子浓度由大到小的顺序为______________________。
②向AG=12的溶液中加入过量NaOH溶液时,主要反应的离子方程式为______________。
(3)肌红蛋白(Mb)可与O2结合生成MbO2:![]() 。37℃时测得肌红蛋白的结合度(α)与p(O2)的关系如下表。
。37℃时测得肌红蛋白的结合度(α)与p(O2)的关系如下表。
[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的物质的量分数]
p(O2)/kPa | 0.50 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 |
α(MbO2)% | 50.0 | 66.7 | 80.0 | 85.7 | 88.9 | 90.9 | 92.3 |
①计算37℃时,上述反应的平衡常数K=__________kPa-1(气体和溶液中的溶质分别用分压和物质的量浓度表示)。
②37℃时,若空气中氧气分压为21.0 kPa,则人正常呼吸时α的最大值为________%(保留1位小数)。
③温度不变时,游客在山顶时体内MbO2的浓度比在山下________(填“高”或“低”)。
④研究发现,v正=k正·c(Mb)·p(O2),v逆=k
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,向A和B中都充人2molX和2molY,起始VA=0.8a L,VB=a L保持温度不变,在有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)![]() 2Z(g)+W(g)达到平衡时,VA=0.9a L,则下列说法错误的是 ( )
2Z(g)+W(g)达到平衡时,VA=0.9a L,则下列说法错误的是 ( )
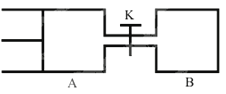
A. 两容器中达到平衡的时间A<B
B. 打开K达到新平衡后,升高B容器温度,A容器体积相比原平衡状态时一定增大
C. A容器中X的转化率为25%,且比B容器中的X的转化率小
D. 打开K一段时间达平衡时,A的体积为0.8a L(连通管中的气体体积不计)
查看答案和解析>>
科目: 来源: 题型:
【题目】高分子化合物G是一种聚酯材料,其一种合成路线如下:

回答下列问题:
(1)A的名称是________,B含有的官能团名称是________。
(2)反应④的反应类型是________。
(3)反应⑥的化学方程式为________。
(4)反应③⑤中引入-SO3H的作用是________。
(5)满足下列条件的C的同分异构体共有________种(不含立体异构)。
①能使FeCl3溶液显紫色;能发生水解反应。②苯环上有两个取代基。
其中核磁共振氢谱显示为5组峰,峰面积之比为3:2:2:2:1,且含有-CH2CH3,该有机物的结构简式是________ (任写一种)。
(6)以CH3CH2CH2OH为原料,设计制备 的合成路线:________。
的合成路线:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)火箭使用的推进剂燃料由N、H两种元素组成,且原子个数N:H=1:2,其水溶液显碱性,则该物质中N原子的杂化方式为______________________。
(2)笑气(N2O)曾被用作麻醉剂,但过度吸食会导致身体机能紊乱。预测N2O的结构式为________________________。
(3)元素的基态气态原子得到一个电子形成气态-1价离子时所放出的能量称作第一电子亲和能(E),-1价阴离子再获得一个电子的能量变化叫做第二电子亲和能,部分元素或离子的电子亲和能数据如下表所示。
元素 | C1 | Br | I | O | O- |
电子亲和能(kJ/mol) | 349 | 343 | 295 | 141 | -780 |
下列说法正确的是___________。
A.电子亲和能越大,说明越难得到电子
B.一个基态的气态氧原子得到一个电子成为O2-时放出141kJ的能量
C.氧元素的第二电子亲和能是-780kJ/mol
D.基态的气态氧原子得到两个电子成为O2-需要吸收能量
(4)在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为:2Al(OH)3+12HF+3Na2CO3=2A+3CO2↑+9H2O。根据题意完成下列填空:
①冰晶石的化学式为____________________________。
②冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是___________(填微粒符号)。
③冰晶石溶液中不存在的微粒间作用力有________________(填选项字母)。
A 离子键 B 共价键 C 配位键 D 金属键 E 范德华力 F 氢键
④Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:

若已知A1的原子半径为d cm,NA代表阿伏加德罗常数,Al的相对原子质量为M,则晶胞中Al原子的配位数为________;Al晶体的密度为__________g.cm-3(用字母表示)。
(5)配合物Fe(CO)5的熔点-20℃,沸点103℃,可用于制备纯铁。Fe(CO)5的结构如图所示。

①Fe(CO)5晶体类型属于__________晶体。
②关于Fe(CO)5,下列说法正确的是_____。
A.Fe(CO)5是非极性分子,CO是极性分子
B.Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1mol Fe(CO)5含有10mol配位键
D.反应Fe(CO)5=Fe+5CO没有新化学键生成
查看答案和解析>>
科目: 来源: 题型:
【题目】Na2S2O5是常用的防腐剂和漂白剂。可利用烟道气中的SO2生产Na2S2O5,其流程如下:
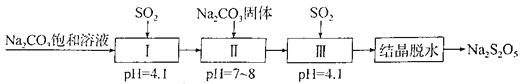
下列说法正确的是
A. 上述制备过程所涉及的物质中只有一种酸性氧化物
B. Na2S2O5作防腐剂和SO2作漂白剂时,均表现还原性
C. 上述流程中的Na2CO3饱和溶液和Na2CO3固体不可互换
D. 实验室模拟“结晶脱水”时用到的仪器只有蒸发皿、玻璃棒、烧杯、漏斗
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积可变的密闭容器中通入一定量的X,发生反应:mX(g)![]() nY(g)+Z(g)△H=QkJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如表所示:
nY(g)+Z(g)△H=QkJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如表所示:
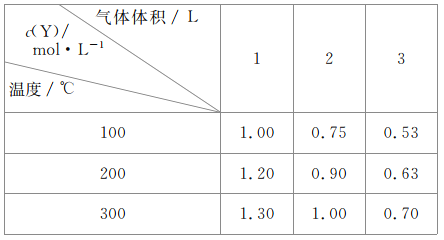
下列说法正确的是
A.m>n+1
B.温度不变,压强增大,Y的体积分数减少
C.Q<0
D.体积不变,温度升高,平衡向逆反应方向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】已知过氧化氢在强碱性溶液中主要以HO2-存在。我国研究的Al-H2O2燃料电池可用于深海资源的勘查、军事侦察等国防科技领域,装置示意图如下。下列说法错误的是
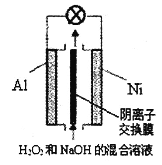
A. 电池工作时,溶液中OH-通过阴离子交换膜向Al极迁移
B. Ni极的电极反应式是HO2-+2e-+H2O=3OH-
C. 电池工作结束后,电解质溶液的pH降低
D. Al电极质量减轻13.5g,电路中通过9.03×1023个电子
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,H2(g)+CO2(g) ![]() H2O(g)+CO(g)的平衡常数K=9/4,该温度下在甲、乙、丙三个体积相同的恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示,
H2O(g)+CO(g)的平衡常数K=9/4,该温度下在甲、乙、丙三个体积相同的恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示,
起始浓度 | 甲 | 乙 | 丙 |
c(H2)(mol/L) | 0.010 | 0.020 | 0.020 |
c(CO2)(mol/L) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是:
A. 平衡时,甲中和丙中H2的转化率均是60%
B. 平衡时, 乙中H2的转化率大于60%
C. 平衡时,丙中c(CO)是甲中的2倍,是0.012 mol/L
D. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢
查看答案和解析>>
科目: 来源: 题型:
【题目】最近有科学家发现正丁烷(![]() )脱氢或不完全氧化也可制得1,3-丁二烯(
)脱氢或不完全氧化也可制得1,3-丁二烯(![]() ),已知热化学方程式如下:( )
),已知热化学方程式如下:( )
①![]() =
=![]()
![]()
②![]() =
=![]()
![]()
③![]() =
=![]()
![]()
下列说法正确的是( )
A.由②可知,正丁烷(![]() )的燃烧热为
)的燃烧热为![]()
B.由①和②可推知:![]() =
=![]()
![]()
C.![]() =
=![]()
![]()
D.由①和②可知,同质量的正丁烷(![]() )转变为1,3-丁二烯(
)转变为1,3-丁二烯(![]() )所需要的能量相同
)所需要的能量相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com