
科目: 来源: 题型:
【题目】化合物H是重要的有机物,可由E和F在一定条件下合成:(部分反应物或产物省略,另请注意箭头的指向)

已知以下信息:
i.A属于芳香烃,H属于酯类化合物。
ii.I的核磁共振氢谱为二组峰,且峰的面积比为6:1。
回答下列问题:
(1)E的含氧官能团名称是 ______ ,B的结构简式是___________________。
(2)B→C和G→J两步的反应类型分别为 ___________,____________。
(3)①E+F→H的化学方程式是____________________________________。
②D与银氨溶液反应的化学方程式是__________________________________。
(4)E的同系物K比E相对分子质量大28,则K的同分异构体共 ______ 种,其中核磁共振氢谱显示为4组峰,且峰面积之比为6:2:1:1,写出符合要求的该同分异构体的结构简式为(写出1种即可) ____________________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于硅单质及其化合物的说法正确的是()
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、陶瓷都是硅酸盐产品
③高纯度的硅单质广泛用于制作光导纤维
④普通玻璃是氧化物,成分可表示为SiO2
⑤粗硅制备单晶硅不涉及氧化还原反应
⑥硅酸铜钡( BaCuSiOx,铜为+2价),x等于6,可用氧化物形式表示为 BaO·CuO·2SiO2
A.①②⑥B.①②③C.①②③④D.②③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】MgSO4·7H2O在医药上常用做泻药,工业上可用氯碱工业中的一次盐泥为原料生产已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分其主要工艺如下:
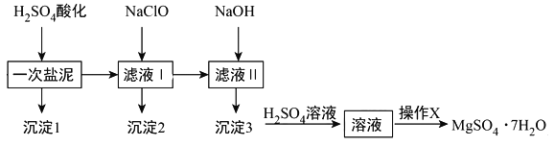
请回答下列问题:
(1)一次盐泥与H2SO4充分反应后,分离沉淀1与滤液I时所用到的玻璃仪器有玻璃棒和___________、____________.
(2)“操作X”是将溶液____________、____________、过滤洗涤,即得到MgSO4·7H2O晶体.
(3)加NaClO溶液至pH=5~6并加热煮沸5-10分钟,沉淀2中主要含有MnO2和另外两种难溶物,这两种难溶物的化学式分别为___________、___________;其中NaClO溶液将MnSO4转化为MnO2的离子方程式为_________________________________.
(4)检验滤液Ⅱ中是否含有Fe3+的实验方法是__________________________.
(5)称量制得的样品5g,用200mL水溶解,加入2mol/L的盐酸5mL,在不断搅拌下滴加足量2mol/LBaCl2溶液,充分反应后,得沉淀4.66 g,则样品纯度为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大。A与E同主族,D与F同主族,且A与D能形成两种液态化合物;B的某种单质是自然界中硬度最大的物质,C与D形成的化合物是大气常见污染物之一。请回答下列问题:
(1)F在元素周期表中的位置是______________,D、E、F三种元素其简单离子半径由大到小的顺序是_______________________用离子符号表示
(2)元素A、C、F形成的化合物(CA4)2F中含有的化学键为_________________。
(3)元素B、C的最高价氧化物对应水化物酸性较强的是填化学式__________,写出该酸的浓溶液与少量铜粉反应的化学方程式_______________________________。
(4)写出由A、C形成的18电子分子的结构式为________________________。
(5)处理含![]() 废水的方法之一是在微生物的作用下,
废水的方法之一是在微生物的作用下,![]() 被D的常见单质氧化成
被D的常见单质氧化成![]() ,同时生成C的简单氢化物,该反应的离子方程式为_____________________。
,同时生成C的简单氢化物,该反应的离子方程式为_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验所用仪器如图:
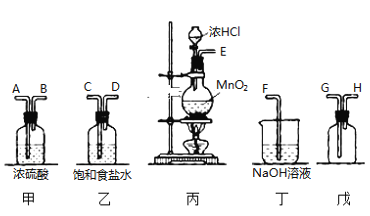
(1)连接上述仪器的正确顺序是 ________________________ 。
(2)气体发生装置中进行反应的离子方程式是_________________________;当0.5molMnO2反应时,生成的Cl2在标准状况下的体积约为 ________L。
(3)在装置中:乙中饱和食盐水的作用是___________________________,甲中浓硫酸的作用是_________________________。
(4)化学实验中检验是否有Cl2产生常用湿润的淀粉-KI试纸,如果有Cl2产生,可观察到的现象是____________________________,写出反应的化学方程式______________________________________。
(5)若用盛有过量烧碱溶液的小烧杯吸收标准状况下VL氯气,充分反应后,溶液中含等物质的量的次氯酸钠和氯酸钠,则反应消耗的NaOH的物质的量为____________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在某密闭容器中发生反应:2HI(g)![]() H2(g)+I2(s)ΔH >0,若0~15 s内c(HI)由0.1 mol·L-1降到0.07 mol·L-1,则下列说法正确的是( )
H2(g)+I2(s)ΔH >0,若0~15 s内c(HI)由0.1 mol·L-1降到0.07 mol·L-1,则下列说法正确的是( )
A. 0~15 s内用I2表示的平均反应速率为v(I2)=0.001 mol·L-1·s-1
B. c(HI)由0.07 mol·L-1降到0.05 mol·L-1所需的反应时间小于10 s
C. 升高温度正反应速率加快,逆反应速率也加快
D. 减小反应体系的体积,正逆反应速率增大程度相等
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式中正确的是()
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:![]()
B.小苏打与氢氧化钠溶液混合:![]()
C.NaHSO4溶液与Ba(OH)2溶液混合后呈中性:![]()
D.二氧化锰和浓盐酸共热:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法” 又叫“联合制碱法”以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱Na2CO3,有关反应的化学方程式:
(1)______________。
(2)______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,浓度均为0.1mol·L-1的四种溶液pH如下表,依据已有的知识和信息进行判断,下列说法正确的是
溶质 | Na2CO3 | NaClO | NaHCO3 | NaHSO3 |
pH | 11.6 | 10.3 | 9.7 | 4.0 |
A. 常温下,HSO3-的水解能力强于其电离能力
B. 向氯水中加入少量NaHCO3固体,不能增大HClO的浓度
C. Na2CO3 溶液中存在以下关系:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
D. 常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH依次升高
查看答案和解析>>
科目: 来源: 题型:
【题目】无水AlCl3易升华,可用作有机合成的催化剂等。工业上以铝土矿(Al2O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下:

(1) 氯化炉中Al2O3、Cl2和C反应的化学方程式为____________________。
(2)用Na2SO3溶液可除去冷却器排出的尾气中的Cl2,此反应的离子方程式为__________。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是________。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.32 g。
① 写出上述除杂过程中涉及的离子方程式___________、____________。
② AlCl3产品的纯度为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com