
科目: 来源: 题型:
【题目】常温下浓度均为0.1mol/L 的四种盐溶液,其pH 如表所示,下列说法正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
pH | 8.8 | 9.7 | 11.6 | 10.3 |
A. 将等浓度的CH3COOH 和HClO溶液,pH小的是HClO
B. Na2CO3和NaHCO3溶液中粒子种类不同
C. 溶液水的电离程度:①>②>④>③
D. NaHCO3溶液中:c (Na+) =c (CO32- )+c (HCO3- )+c (H2CO3)
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下图所示装置回答以下问题。已知:①KMnO4常温下与浓盐酸反应可制得Cl2。②H2SiO3不溶于水。

(1)利用如图装置可以验证元素非金属性的变化规律。图中A装置的名称是________________。干燥管D的作用是____________。
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性强于硫:烧瓶中发生反应的离子方程式为____________________________。装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_____________________。
(3)若要用此装置证明酸性:HNO3>H2CO3>H2SiO3,进而证明非金属性:N>C>Si,从以下所给物质中选出甲同学设计的实验所用到的物质:①稀HNO3 ②稀盐酸 ③碳酸钙 ④Na2SiO3溶液 ⑤SiO2。试剂A与C分别为________(填序号);试管中发生反应的离子方程式为__________________。有同学认为此实验不能说明N、C、Si的非金属性强弱,你认为原因是_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙酰水杨酸(阿司匹林)是目前常用药物之一。实验室通过水杨酸进行乙酰化制备阿司匹林的一种方法如下:
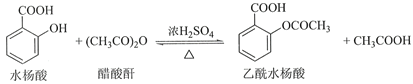
水杨酸 | 醋酸酐 | 乙酰水杨酸 | |
熔点/℃ | 157~159 | -72~-74 | 135~138 |
相对密度/(g·cm﹣3) | 1.44 | 1.10 | 1.35 |
相对分子质量 | 138 | 102 | 180 |
实验过程:在100 mL锥形瓶中加入水杨酸6.9 g及醋酸酐10 mL,充分摇动使固体完全溶解。缓慢滴加0.5 mL浓硫酸后加热,维持瓶内温度在70 ℃左右,充分反应。稍冷后进行如下操作.
①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤。
②所得结晶粗品加入50 mL饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤得固体。
④固体经纯化得白色的乙酰水杨酸晶体5.4 g。
回答下列问题:
(1)该合成反应中应采用__________加热。(填标号)
A.热水浴 B.酒精灯 C.煤气灯 D.电炉
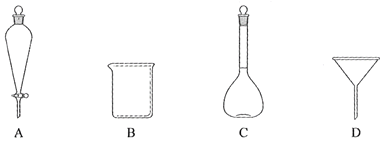
(2)下列玻璃仪器中,①中需使用的有________(填标号),不需使用的_______________________(填名称)。
(3)①中需使用冷水,目的是______________________________________。
(4)②中饱和碳酸氢钠的作用是_________________________________,以便过滤除去难溶杂质。
(5)④采用的纯化方法为____________。
(6)本实验的产率是_________%。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚氯酸钠是一种高效氧化剂、漂白剂,主要用于亚麻、纸浆等漂白。NaClO2在溶液中可生成ClO2、HClO2、ClO2-、Cl-等含氯微粒,经测定,25 ℃时各组分含量随pH变化情况如图所示(部分没有画出)。则下列分析不正确的是

A. 亚氯酸钠在碱性条件下较稳定
B. 25 ℃时,HClO2的电离平衡常数Ka=10-6
C. 25 ℃,pH=3时NaClO2溶液中c(Na+)+c(H+)=c(ClO2-)+c(OH-)
D. 等浓度的HClO2溶液和NaClO2溶液等体积混合的溶液中(pH<7):c(ClO2-)>c(Na+)>c(HClO2)>c(H+)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 燃料电池具有理论电压高、能量密度大等优点。以该燃料电池为电源电解精炼铜的装置如图所示。下列说法不正确的是
燃料电池具有理论电压高、能量密度大等优点。以该燃料电池为电源电解精炼铜的装置如图所示。下列说法不正确的是
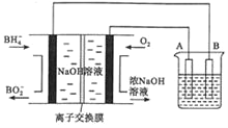
A. 每消耗2.24![]() (标准状况)时,A电极的质量减轻12.8g
(标准状况)时,A电极的质量减轻12.8g
B. 离子交换膜应为阳离子交换膜,![]() 由左极室向右极室迁移
由左极室向右极室迁移
C. 该燃料电池的负极反应式为![]()
D. 粗铜中的Ag、Au沉在阳极区,电解质溶液的浓度基本保持不变
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示为钠硫高能电池的结构示意图,M由Na2O和Al2O3制得,该电池的工作温度为320℃左右,电池反应为2Na+xS=Na2Sx。下列说法不正确的是
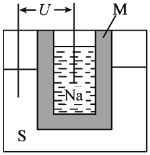
A. 负极反应式为Na - e- = Na+
B. 放电时,消耗32 g正极活性物质,转移的电子为2 mol
C. M的作用是导电和隔离钠与硫
D. 消耗相同质量的负极活性物质,钠硫电池的理论放电量是铅蓄电池的4.5倍
查看答案和解析>>
科目: 来源: 题型:
【题目】t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10,下列说法不正确的是
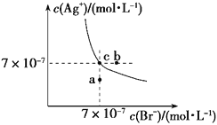
A. 在t ℃时,AgBr的Ksp为4.9×10-13
B. 通过蒸发,可使溶液由a点变到c点
C. 图中b点有AgBr沉淀析出
D. 在t ℃时,AgCl(s)+Br-(aq) ![]() AgBr(s)+Cl-(aq)的平衡常数K≈816
AgBr(s)+Cl-(aq)的平衡常数K≈816
查看答案和解析>>
科目: 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:

(1)氢氧燃料电池的能量转化主要形式是______,在导线中电子流动方向为___________(用a、b 表示)。
(2)负极反应式为________。
(3)电极表面镀铂粉的原因为___________________________。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2![]()
![]() 2LIH
2LIH
Ⅱ.LiH+H2O==LiOH+H2↑
①反应Ⅰ中的还原剂是_____,反应Ⅱ中的氧化剂是_____。
②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为________。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为___________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】在平衡体系Ca(OH)2(s)![]() Ca2+ +2OH一中,能使c(Ca2+)减小,而使c(OH一)增大的是
Ca2+ +2OH一中,能使c(Ca2+)减小,而使c(OH一)增大的是
A. 加入少量MgCl2固体 B. 加入少量Na2CO3固体
C. 加入少量KCl固体 D. 加入少量稀H2SO4
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室在 500℃时,隔绝空气加热硫酸亚铁铵[(NH4)2Fe(SO4)2]至分解完全并确定分解产物成分的装置如图所示 (已知分解的固体产物可能有 FeO、Fe2O3 和 Fe3O4,气体产物可能有 NH3、N2、H2O、SO3 和 SO2)。下列说法正 确的是( )
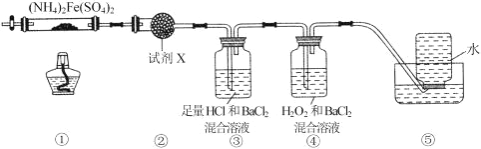
A. 取①中固体残留物与稀硫酸反应并滴加 KSCN,溶液变红,则残留物一定为 Fe2O3
B. 装置②用于检验分解产物中是否有水蒸气生成,试剂 X 最好选用碱石灰
C. 装置③用于检验分解产物中是否有 SO3 气体生成并除去 SO3 和 NH3
D. 装置④用于检验分解产物中是否有 SO2 气体生成,装置⑤用于收集生成的 NH3 和 N2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com