
科目: 来源: 题型:
【题目】现有甲、乙、丙、丁四个装置,下列说法不正确的是
A.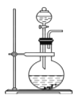 装置甲可作为制取NO2的发生装置
装置甲可作为制取NO2的发生装置
B. 装置乙可作为制取NO的收集装置
装置乙可作为制取NO的收集装置
C.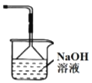 装置丙可作为制取Cl2的尾气吸收装置
装置丙可作为制取Cl2的尾气吸收装置
D. 装置丁可用于除去NH3中H2O
装置丁可用于除去NH3中H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组为验证浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO,设计如图装置进行实验(夹持仪器已略去)。(查阅资料):NO与NaOH溶液不反应,NO2与NaOH溶液能反应(反应的化学方程式为2NO2+2NaOHNaNO3+NaNO2+H2O)。
备选药品:浓硝酸、3mol·L-1稀硝酸、蒸馏水、浓硫酸、NaOH溶液及CO2气体。回答下列问题。

(1)连接好装置,滴加浓硝酸之前的操作依次是:____________,加入药品,打开装置①中的弹簧夹后通入CO2一段时间,关闭弹簧夹,将装置④中导管末端伸入倒置的烧瓶内。通入CO2的目的是____________。
(2)若用质量分数为70%浓硝酸(密度为1.42g·cm-3)配制250mL3mol·L-1的稀硝酸,除量筒、烧杯、胶头滴管外,还要用到的玻璃仪器有____________、____________。
(3)装置①中发生反应的化学方程式为____________。
(4)装置①中产生的气体通过盛有水的洗气瓶时发生反应的化学方程式为____________。
(5)根据实验设计,装置②中盛放的试剂是____________。
(6)做实验时应避免有害气体排放到空气中,装置⑤中盛放的药品是____________。
(7)验证浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO的实验现象是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)相对分子质量为70的烯烃的分子式为___________________;若该烯烃与足量的H2加成后能生成含3个甲基的烷烃,则该烯烃的可能的结构简式为___________________;
(2)有机物A的结构简式为

①若A是单烯烃与氢气加成后的产物,则该单烯烃可能有________种结构;
②若A是炔烃与氢气加成后的产物,则此炔烃可能有________种结构;
③若A的一种同分异构体只能由一种烯烃加氢得到,且该烯烃是一个非常对称的分子构型,有顺、反两种结构。
a.写出A的该种同分异构体的结构简式 ______________________;
b.写出这种烯烃的顺、反异构体的结构简式 _____________________;
(3)  与Br2的加成产物有________________种;
与Br2的加成产物有________________种;
(4)C5H12O的同分异构体有_________种,其中属于醇类且能被氧化成醛的有______种,能消去H2O生成烯的醇有__________种,生成的烯有_______种;
(5)写出由1个 —C6H4—(苯环)、2个—CH2—、1一个—OH、两个—CH3,1 个![]() 组成的能使FeCl3变紫色且苯环上的一氯取代产物有两种的有机物有多少种 __________;
组成的能使FeCl3变紫色且苯环上的一氯取代产物有两种的有机物有多少种 __________;
(6)相同状况下9升甲烷与6升某烯烃混合, 所得混合气的密度等于相同条件下氧气的密度,则该烯烃的分子式___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. 向![]() 溶液中滴加氨水至过量:
溶液中滴加氨水至过量:![]()
B. 向![]() 悬浊液中滴加
悬浊液中滴加![]() 溶液:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+
溶液:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+
C. 向![]() 溶液中加入足量稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O
溶液中加入足量稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O
D. 向苯酚钠溶液中通入少量![]() 气体:2C6H5O-+CO2+H2O=2C6H5OH+CO32-
气体:2C6H5O-+CO2+H2O=2C6H5OH+CO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】化学在生产和生活中有着重要的作用。下列有关说法不正确的是( )
A. 焊接金属时常用![]() 溶液做除锈剂
溶液做除锈剂
B. 嫦娥系列卫星中使用的碳纤维,是一种新型无机非金属材料
C. 只要符合限量,“食用色素”、“亚硝酸盐”可以作为某些食品的添加剂
D. PM2.5是指大气中直径小于或等于2.5微米的颗粒物,是发生雾霾天气的主要原因,这些颗粒物扩散在空气中都会形成胶体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是![]()
![]()
A. 向![]() 溶液中加入少量水,溶液中
溶液中加入少量水,溶液中![]() 减小
减小
B. 将![]() 溶液从
溶液从![]() 升温至
升温至![]() ,溶液中
,溶液中![]() 增大
增大
C. 向盐酸中加入氨水至中性,溶液中![]()
D. 向AgCl、AgBr的饱和溶液中加入少量![]() ,溶液中
,溶液中![]() 不变
不变
查看答案和解析>>
科目: 来源: 题型:
【题目】铁及其化合物在日常生产生活中应用广泛,研究铁及其化合物的应用意义重大。FeSO47H2O广泛用于医药和工业领域,以下是测定某补血剂(有效成分为FeSO47H2O)中铁元素含量的流程图。根据题意完成下列填空:

(1)人体能够吸收的是+2价的铁,但是+2价的铁很容易被氧化。补血剂与维生素C一起服用,有利于+2价铁的吸收。由此可推知,维生素C具有____________(填“氧化性”或“还原性”)。
(2)步骤Ⅱ需要100mL1mol·L-1的稀硫酸,实验室用质量分数为98%的浓硫酸(密度为1.84g·cm-3)来配制,需用量筒量取浓硫酸____________mL。
(3)步骤Ⅲ所得滤液中滴加KSCN溶液后滤液变为红色,则滤液中含有____________(填离子符号)。检验滤液中还存在Fe2+,应选用的试剂为____________(填字母)
A.NaCl溶液B.酸性KMnO4溶液C.NaOH溶液
(4)步骤Ⅳ加入过量H2O2的目的是____________(用离子方程式表示)。
(5)步骤Ⅵ的一系列操作依次是:①过滤②洗涤③____________④冷却⑤称量⑥恒重操作,操作⑥的目的是____________。
(6)假设实验无损耗,则每片补血剂含铁元素的质量为____________g(用含a的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于电解质溶液中离子关系的说法正确的是( )
A. 0.1 mol·L-1NaHCO3溶液中离子浓度关系:c(Na+)=2c(![]() )+c(
)+c(![]() )+c(H2CO3)
)+c(H2CO3)
B. 把0.2 mol/L NH4Cl溶液与0.1 mol/L NaOH溶液等体积混合后离子浓度关系:c(Cl-)>c(![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
C. 常温,向醋酸钠溶液中滴加少量醋酸使其pH=7,则混合液中:c(Na+)=c(CH3COO-)
D. 在Na2CO3溶液中,c(H+)+c(![]() )+c(H2CO3)= c(OH-)
)+c(H2CO3)= c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素。在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去)。

请回答下列问题:
(1)若A是黄绿色的气体,D是铁单质。则B是____________(填化学式),反应③的离子方程式为__________________。
(2)若A是一种有刺激性气味的气体,其水溶液呈碱性;B和C是常见的氧化物且C是红棕色气体。则反应①的化学方程式为____________,A的用途有____________(任写一种)。
(3)若A、C、D都是气体,B是一种(淡)黄色的固体单质,C是形成酸雨的主要物质。在标准状况下,反应③中消耗6.72L的A,则转移的电子数为____________。
(4)若A是钠盐,B俗称小苏打,则反应②的离子方程式为____________;配制250mL0.1mol·L-1Na2CO3溶液,需要用托盘天平称量Na2CO310H2O晶体的质量为____________克。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚氯酸钠(![]() )是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:

已知:①![]() 的溶解度随温度升高而增大,适当条件下可结晶析出
的溶解度随温度升高而增大,适当条件下可结晶析出![]() 。
。
②纯![]() 易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
(1)钠元素在周期表的位置___________;![]() 的电子式____________
的电子式____________
(2)发生器中鼓入空气的作用可能是_____________(选填序号).
a.将![]() 氧化成
氧化成![]() ,增强酸性 b.稀释
,增强酸性 b.稀释![]() 以防止爆炸
以防止爆炸
c.将![]() 氧化成
氧化成![]() d.加大容器压强,加快反应速率
d.加大容器压强,加快反应速率
(3)吸收塔内发生反应的化学方程式:___________________________;
(4)从滤液中得到![]() ,粗晶体的实验操作依次是_________(选填序号)。
,粗晶体的实验操作依次是_________(选填序号)。
a.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶
(5)![]() 被
被![]() 还原为
还原为![]() 的转化率与溶液pH的关系如图所示。
的转化率与溶液pH的关系如图所示。![]() 时,被S2-还原的产物ClO2-、Cl-物质的量的比______;写出
时,被S2-还原的产物ClO2-、Cl-物质的量的比______;写出![]() 时
时![]() 与
与![]() 反应的离子方程式______________________。
反应的离子方程式______________________。

Ⅱ.铁和铜及其化合物在人类生产生活中具有重要作用,回答下列问题:
(6)中国古代四大发明之一的司南由天然磁石制成。其主要成分是__________(填字母序号)。
a.![]() b.
b.![]() c.
c.![]() d.
d.![]()
(7)中国古代制造的青铜器久置空气中发生电化学腐蚀生成铜绿,则正极反应式为___________,若利用稀盐酸擦拭铜绿,其离子方程式为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com