
科目: 来源: 题型:
【题目】一定温度下,某一密闭且体积不变的容器内有可逆反应A(g)+3B(g)![]() 2C(g)。该反应进行到一定限度后达到了化学平衡,该化学平衡的标志是( )
2C(g)。该反应进行到一定限度后达到了化学平衡,该化学平衡的标志是( )
A.C物质的生成速率和分解速率相等
B.容器内气体的密度不再随时间而改变
C.单位时间内生成amol物质A,同时生成3amol物质B
D.A、B、C的分子数之比为1:3:2
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。已知:铅蓄电池在放电时发生下列电极反应:负极Pb+SO42--2e-===PbSO4正极PbO2+4H++SO42-+2e-===PbSO4+2H2O
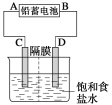
(1)请写出电解饱和食盐水的化学方程式____________。
(2)若在电解池D极滴酚酞试液,电解一段时间后呈红色,说明铅蓄电池的B极为___极。
(3)用铅蓄电池电解2 L饱和食盐水(电解过程假设体积不变)
①若收集到11.2 L(标准状况下)氯气,则至少转移电子________mol。
②若铅蓄电池消耗H2SO4 2 mol,则可收集到H2的体积(标准状况下)为________L。
③若消耗硫酸a mol,电解后除去隔膜,所得溶液中NaOH的物质的量浓度为(假设氯气全部排出)______________(用含a的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如右:

回答下列问题:
(1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为:__________________、_______________。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是___________,滤渣是________;过滤操作②的滤液是____________和____________,滤渣是_______。
(3)工艺过程中③和④的目的是______________。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是____________________。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。
称量草酸成品0.250 g溶于水,用0.0500 mol·L-1的酸性KMnO4溶液滴定,至浅粉红色不消褪,消耗KMnO4溶液15.00 mL,反应的离子方程式为__________________;
列式计算该成品的纯度____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有一瓶澄清的溶液,其中可能含有NH![]() 、K+、Mg2+、Ba2+、Al3+、Fe3+、SO42-、CO32-、NO3-、I-、Cl-,取该溶液进行以下实验:
、K+、Mg2+、Ba2+、Al3+、Fe3+、SO42-、CO32-、NO3-、I-、Cl-,取该溶液进行以下实验:
①用pH试纸测得该溶液呈酸性;
②取部分溶液,加入数滴新制的氯水及少量CCl4,经振荡、静置后,CCl4层呈紫红色;
③另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐变为碱性,在整个滴加过程中无沉淀生成;
④取部分上述碱性溶液,加入Na2CO3溶液,有白色沉淀生成;
⑤将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实回答问题:
(1)写出②所发生反应的离子方程式_________。
(2)该溶液中肯定存在的离子是________。
(3)该溶液中肯定不存在的离子是________。
(4)该溶液中还不能确定是否存在的离子是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应A(g)+3B(g)![]() 2C(g)+2D(g),在下列四个选项中是不同的情况下测得的不同物质的反应速率,其中表示该化学反应的反应速率最快的是
2C(g)+2D(g),在下列四个选项中是不同的情况下测得的不同物质的反应速率,其中表示该化学反应的反应速率最快的是
A.υ(A)=0.2mol(L·min)B.υ(B)=0.45 mol(L·s)
C.υ(C)=0.40 mol(L·min)D.υ(D)=0.35 mol(L·min)
查看答案和解析>>
科目: 来源: 题型:
【题目】常见气体在标准状况下的密度为1.25 g·L-1。
(1)该气体的相对分子质量为________。
(2)若该气体的分子式为A2型,其名称为________;
若该气体的分子式为AB型,其名称为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,属于加成反应的是
A.CH4+Cl2![]() CH3Cl+HCl
CH3Cl+HCl
B.CH2=CH2+HCl![]() CH3CH2Cl
CH3CH2Cl
C.2CH3CH2OH+O2![]() 2CH3CHO +2H2O
2CH3CHO +2H2O
D.![]() +Br2
+Br2![]()
![]() +HBr
+HBr
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组在实验室从海带灰中提取碘并制备KI晶体。请回答下列问题
(1)从水溶液中萃取碘可以选用的试剂是____________。(填序号)
A.酒精 B.CCl4 C.己烯 D.直馏汽油
(2)KI晶体的制备,实验装置如图:

实验步骤如下
i.配制0.5mol·L1的KOH溶液。
i.在三颈瓶中加入12.7g单质I2和250mL 0.5mol·L1的KOH溶液,搅拌至碘完全溶解。
ⅲ.通过滴液漏斗向反应后的溶液中滴加适量甲酸,充分反应后,HCOOH被氧化为CO2,再用KOH溶液调pH至9~10,将所得溶液蒸发浓缩,冷却结晶、过滤、洗涤、干燥。得KI产品8.3g。请回答下列问题:
①配制0.5mol·L1 KOH溶液时,下列操作导致配得的溶液浓度偏高的是_____(填序号)。
A.托盘上分别放置质量相等的纸片后称量KOH固体
B.KOH固体样品中混有K2O2
C.称量好的固体放入烧杯中溶解未经冷却直接转移入容量瓶
D.未洗涤烧杯及玻璃棒直接向容量瓶中加水定容
E.定容时仰视刻度线
②步骤ⅱ中I2与KOH溶液反应生成的氧化产物和还原产物的物质的量之比为1∶5,请写出氧化产物的化学式:____________。
③步骤ⅲ中向溶液中滴加适量甲酸时,需打开活塞___________。(填“a”“b”或“a和b”)
④实验中,加入HCOOH发生氧化还原反应的离子方程式为____________________。
⑤实验中KI的产率为________________%
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在,实验室里从海藻中提取碘的流程如图:
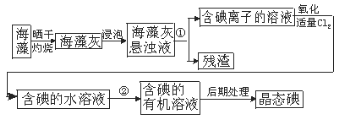
(1)指出制取碘的过程中有关的实验操作名称:
①_________________________
②_________________________
(2)提取碘的过程中.可供选择的有机试剂是_______________。
A.甲苯、酒精 B.四氯化碳、苯 C.汽油、乙酸 D.汽油、甘油
(3)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器是____________。
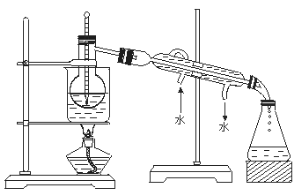
(4)从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏。观察上述实验装置指出其错误之处,并加以改正。_____________________________________________________________
(5)进行上述蒸馏操作时,使用水浴的原因是________________________________。最后晶态碘在______________里聚集。
查看答案和解析>>
科目: 来源: 题型:
【题目】水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是
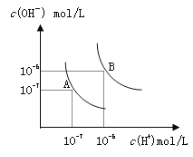
A. 纯水中25℃时的c(H+)比100℃时的c(H+)大
B. 100℃时某溶液中由水电离产生的c(H+)=1×10-11mol/L,则该溶液的pH可能是11或3
C. 将pH=9的Ba(OH)2溶液与pH=4的稀盐酸混合,并保持100℃的恒温,混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为10: 1
D. 25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,则溶液中c(Na+):c(OH-)为104:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com