
科目: 来源: 题型:
【题目】四氢铝锂(LiAlH4)常作有机合成的重要还原剂。以辉锂矿(主要成分Li2OAl2O34SiO2,含少量Fe2O3)为原料合成四氢铝锂的流程如图:
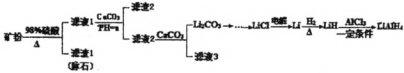
已知:①几种金属氢氧化物沉淀的pH如表所示:
物质 | Fe(OH)3 | A1(OH)3 |
开始沉淀的pH | 2.3 | 4.0 |
完全沉淀的pH | 3.7 | 6.5 |
②常温下,Ksp(Li2CO3)=2.0×10-3。Li2CO3在水中溶解度随着温度升高而减小。
回答下列问题:
(1)上述流程中,提高“酸浸”速率的措施有____ (写两条);加入CaCO3的作用是____,“a”的最小值为____。
(2)用热水洗涤Li2CO3固体,而不用冷水洗涤,其目的是___;检验碳酸锂是否洗净的实验操作是___。
(3)写出LiH和AlCl3反应的化学方程式:___(条件不作要求)
(4)设计简单方案由Li2CO3制备无水LiCl:___。
(5)在有机合成中,还原剂的还原能力通常用“有效氢”表示,其含义是1克还原剂相当于多少克氢气的还原能力,LiAlH4的“有效氢"为___。(结果保留2位小数)
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】现有四种金属晶体:Na、Zn、Po、Au,如图所示为金属原子的四种基本堆积模型。请回答以下问题:

(1)堆积方式的空间利用率最低的基本堆积模型是___(填编号),符合该堆积模型的金属晶体是______(填化学符号)。
(2)金属原子在二维平面里放置得到密置层和非密置层,其中非密置层的配位数是_____,由非密置层互相错位堆积而成的基本堆积模型是_____(填编号),符合该堆积模型的金属晶体是_____(填化学符号)。
(3)按ABCABCABC……方式堆积的基本堆积模型是____(填编号),符合该堆积模型的金属晶体是______(填化学符号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:
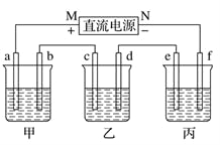
(1)b极上的电极反应式为__,甲电池的总反应化学方程式是__。
(2)在粗铜的电解过程中,图中c电极的材料是__(填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为__;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是__,电解一段时间后,电解液中的金属离子有__。
(3)如果要在铁制品上镀镍(二价金属,相对原子质量59),则f电极的材料是__(填“铁制品”或“镍块”,下同),e电极的材料是__。
(4)若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】现以淀粉或乙烯为主要原料都可以合成乙酸乙酯,其合成路线如图所示。

(已知:2CH3CHO+O2![]() 2CH3COOH)
2CH3COOH)
(1)A中含有的官能团名称是______________;其中③的反应类型是______________;
⑥的反应类型是______________;
(2)写乙烯的电子式:_________________乙烯的结构简式:____________;
(3)写出下列反应的化学方程式:①__________________;⑤______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填写下列空白:
(1)写出表示含有8个质子、10个中子的原子的化学符号:__________。
(2)周期表中最活泼的非金属元素位于第__________纵行。
(3)周期表中位于第4周期、ⅡA族的元素符号是:___________ 。
(4)所含元素为18种的周期是第_________周期、第________周期。
(5)写出第2周期、ⅤA族元素单质的电子式:______________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol/L的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A. 当加入氨水的体积为10 mL时,c(NH4+)=c(CH3COO-)
B. c(NH4+)/c(NH3·H2O)先增大再减小
C. 水的电离程度始终增大
D. c(CH3COOH)与c(CH3COO-)之和始终保持不变
查看答案和解析>>
科目: 来源: 题型:
【题目】将浓度为0.1 mol/L HF溶液加水不断稀释,下列各量始终保持增大的是( )
A. c(H+) B. Ka(HF) C. c(F-) D. c(H+)/c(HF)
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示。下列判断正确的是
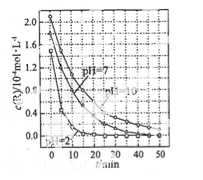
A.在0-50min之间, pH =2 和 PH= 7 时 R 的降解百分率相等
B.溶液酸性越强, R 的降解速率越小
C.R的起始浓度越小,降解速率越大
D.在 20-25min之间, pH = 10 时 R 的平均降解速率为 0.04mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】含苯酚的工业废水的处理流程如图所示。
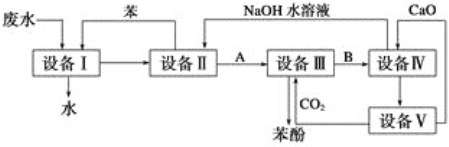
(1)①流程图设备Ⅰ中进行的是操作________(填写操作名称)。实验室里这一步操作可以用_______(填仪器名称)进行。
②由设备Ⅱ进入设备Ⅲ的物质A是______________(填化学式,下同)。由设备Ⅲ进入设备Ⅳ的物质B是___________。
③在设备Ⅲ中发生反应的化学方程式为_____________________。
④在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和______。通过 _________________(填操作名称)操作,可以使产物相互分离。
⑤图中,能循环使用的物质是_______、_____________C6H6和CaO。
(2)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中有无苯酚,此方法是____________。
从废水中回收苯酚的方法是①用有机溶剂萃取废液中的苯酚;②加入某种药品的水溶液使苯酚与有机溶剂脱离;③加入某物质又析出苯酚。试写出②、③两步的反应方程式:_________________________。
(3)为测定废水中苯酚的含量,取此废水100 mL,向其中加入浓溴水至不再产生沉淀为止,得到沉淀0.331 g,求此废水中苯酚的含量____________(mg·L-1)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com