
科目: 来源: 题型:
【题目】如图装置中,在U形管底部盛有CCl4,分别在U形管两端小心倒入饱和食盐水和稀硫酸溶液,并使a、b两处液面相平,然后分别塞上插有生铁丝的塞子,密封好,放置一段时间后,下列有关叙述中错误的是

A. 铁丝在两处的腐蚀速率:a < b
B. a、b两处相同的电极反应式为Fe-2e-==Fe2+
C. 一段时间后,a处液面高于b处液面
D. 生铁丝中的碳在a、b两处分别作原电池的负极和正极
查看答案和解析>>
科目: 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12,下列说法正确的是( )
A. 向含有浓度均为0.010 mol·L-1的Cl-和Br-溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,先产生沉淀的离子为Cl-
B. 向饱和AgCl水溶液中加入浓盐酸,Ksp值变大
C. 向AgCl悬浊液中加入足量KBr溶液,沉淀将由白色转化为淡黄色
D. 由方程式:Ag2CrO4(s)![]() 2Ag+(aq)+CrO42-(aq),可推知Ag2CrO4的饱和溶液一定有2c(Ag+)=c(CrO42-)
2Ag+(aq)+CrO42-(aq),可推知Ag2CrO4的饱和溶液一定有2c(Ag+)=c(CrO42-)
查看答案和解析>>
科目: 来源: 题型:
【题目】在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。下列判断不正确的是( )

A. 原上层液体可能是KI的水溶液,原下层液体可能是CCl4
B. 搅拌后两层液体颜色发生变化的原因是I2在CCl4中的溶解度大于在水中溶解度,所以绝大部分I2都转移到CCl4中
C. 阴极区域pH增大的原因是水分子得电子生成了OH—
D. 阳极上的电极反应式2H++2e - =H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列两个图象:

下列反应中符合上述图象的是( )
A. N2(g)+3H2(g)![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
B. 2SO3(g)![]() 2SO2(g)+O2(g) ΔH>0
2SO2(g)+O2(g) ΔH>0
C. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH<0
4NO(g)+6H2O(g) ΔH<0
D. H2(g)+CO(g)![]() C(s)+H2O(g) ΔH>0
C(s)+H2O(g) ΔH>0
查看答案和解析>>
科目: 来源: 题型:
【题目】下列方程式书写正确的是( )
A. NaHSO4在水溶液中的电离方程式:NaHSO4===Na++HSO4-
B. HF与NaOH溶液反应:H+(aq)+OH-(aq) = H2O(l) ΔH=-57.3 kJ/mol
C. 1g H2燃烧生成液态水放出142.9 kJ的热量,其热化学方程式:2H2(g)+ O 2(g) = 2H2O (l) ΔH = —142.9 kJ·mol-1
D. CaCO3沉淀溶解平衡方程式:CaCO3(s) ![]() Ca2+(aq)+CO32-(aq)
Ca2+(aq)+CO32-(aq)
查看答案和解析>>
科目: 来源: 题型:
【题目】某反应由两步反应A![]() B
B![]() C构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能)。下列有关叙述正确的是
C构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能)。下列有关叙述正确的是

A. 三种化合物的稳定性顺序:B﹤A﹤C
B. 两步反应均为放热反应
C. 加入催化剂不改变反应的焓变,但能提高产率
D. 整个反应的ΔH=E1-E2
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ(1)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。则H2S的平衡转化率为______%,反应平衡常数K=________。
COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。则H2S的平衡转化率为______%,反应平衡常数K=________。
(2)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。若氨水的浓度为2.0 mol·L1,溶液中的c(OH)=_______mol·L1,0.1 mol·L1的(NH4)2SO3溶液显______(填“酸性”、“碱性”或“中性”)。
Ⅱ. 某学生用0.200mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是______ (填编号)。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入______ 中(从图中选填“甲”或“乙”)。

(3)下列操作会引起实验结果偏大的是:______![]() 填编号
填编号![]() 。
。
A. 在锥形瓶装液前,留有少量蒸馏水
B. 滴定前,滴定管尖嘴有气泡,滴定后无气泡
C. 滴定终点俯视读数
查看答案和解析>>
科目: 来源: 题型:
【题目】可降解高分子材料P的结构为: 。如图是P的合成路线。
。如图是P的合成路线。

已知:![]() +R3OH
+R3OH![]() +R2OH
+R2OH
(1)B的结构简式是_______,试剂a是_______。
(2)![]() 中官能团的名称是_____、_____。
中官能团的名称是_____、_____。
(3)③的化学方程式是______。
(4)⑥的反应类型是_____。
(5)G与E互为同分异构体,符合下列要求的G共有______种。(不考虑立体异构)
①含有和E(C6H10O3)相同的含氧官能团②分子中含有六元环状内酯结构
(6)当④中反应物以物质的量之比1:1发生反应时,反应⑤的化学方程式是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】Fritz Haber在合成氨领域的贡献距今已经110周年,氮族元素及其化合物应用广泛。
(1)在基态13N原子中,核外存在__________对自旋相反的电子,核外电子占据的最高能级的电子云轮廓图为__________形。
(2)根据价层电子对互斥理论,NH3、NO3-、NO2-中,中心原子价层电子对数不同于其他两种粒子的是________,与NO3-互为等电子体的分子为__________。液氨中存在电离平衡2NH3![]() NH4++NH2-,根据价层电子对互斥理论,可推知NH2-的空间构型为__________,液氨体系内,氮原子的杂化轨道类型为________。NH3比PH3更容易液化的原因为__________________。
NH4++NH2-,根据价层电子对互斥理论,可推知NH2-的空间构型为__________,液氨体系内,氮原子的杂化轨道类型为________。NH3比PH3更容易液化的原因为__________________。
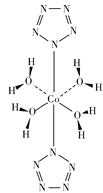
(3)我国科学工作者实现世界首次全氮阴离子(N5-)金属盐Co(N5)2(H2O)4·4H2O的合成,其结构如图所示,可知N5-的化学键类型有______________。
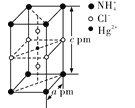
(4)把特定物质的量之比的NH4Cl和HgCl2在密封管中一起加热时,生成晶体X,其晶胞的结构图及晶胞参数如图所示。则晶体X的化学式为__________,其晶体密度为__________(设阿伏加德罗常数的值为NA,列出计算式)g·cm-3。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是课外活动小组设计的用化学电源使LED灯发光的装置。下列说法正确的是
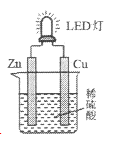
A. 溶液中的SO42-向铜极移动
B. 锌片为原电池的负极,发生还原反应
C. 如果将稀硫酸换成柠檬汁,导线中不会有电子流动
D. 铜片表面有气泡生成,发生的反应为:2H++2e-=H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com