
科目: 来源: 题型:
【题目】在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和c(H+)都相等,向两烧杯中同时加入两颗锌粒,反应结束后得到等量的氢气,有一个烧杯中有锌粒剩余。下列说法正确的是
A. 两烧杯中参加反应的锌等量
B. 盐酸物质的量浓度比醋酸大
C. 乙烧杯中的锌粒剩余
D. 甲烧杯的反应时间更短
查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7:17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色。下列判断正确的是( )
A.气态氢化物的稳定性:X﹥W
B.金属性:Y﹥Z
C.最高价含氧酸的酸性:X﹥W
D.原子半径:Y﹥Z﹥X
查看答案和解析>>
科目: 来源: 题型:
【题目】铁、钴、镍等金属及其化合物在科学研究和工业生产中应用十分广泛。回答下列问题:
(1)铁、钴、镍的基态原子核外未成对电子数最多的是_________。
(2)酞菁钴分子的结构简式如图所示,中心离子为钴离子,酞钴分子中与钴离子通过配位键结合的氮原子的编号是_______(填1、2、3、4),三种非金属原子的电负性由大到小的顺序为_______(用相应的元素符号表示);氮原子的杂化轨道类型为________。

(3)Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x,晶体属于_______(填晶体类型),若配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=________。
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO______FeO(填“>”“<”或“=”),原因是_________。
(5)NiAs的晶胞结构如图所示:①镍离子的配位数为_________。
②若阿伏加德罗常数的值为NA,晶体密度为pg·cm-3,则该晶胞中最近的Ni2+之间的距离为________cm。(写出计算表达式)
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒温、恒容的密闭容器中进行反应 A(g)═B(g)+C(g),若反应物的浓度由2molL-1 降到 0.8molL-1 需要 20s,那么反应物浓度再由 0.8molL-1 降到 0.2molL-1 所需要的时间为
A.10sB.大于 10sC.小于 10sD.无法判断
查看答案和解析>>
科目: 来源: 题型:
【题目】对于放热反应Zn+H2SO4=ZnSO4+H2↑,下列叙述正确的是( )

A. 反应过程中的能量关系可用上图表示
B. 1 mol Zn的能量大于1 mol H2的能量
C. 若将其设计为原电池,则其能量转化形式为电能转化为化学能
D. 若将其设计为原电池,当有32.5gZn溶解时,正极放出的气体一定为11.2L.
查看答案和解析>>
科目: 来源: 题型:
【题目】研究氮及其化合物对化工生产有重要意义。
(1)已知:N2(g)+O2(g)=2NO(g); △H=+180 kJ·mol-1
4NH3(g)+5O2(g) =4NO(g)+6H2O(g); △H= -908 kJ·mol-1
请写出氨气被一氧化氮氧化生成无毒气体的热化学方程式:___________。
(2)工业合成氨的原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1。下图甲表示在一定体积的密闭容器中反应时N2的物质的量浓度随时间的变化,图乙表示在其他条件不变的情况下,改变起始投料中H2与N2的物质的量之比(设为k)对该平衡的影响。
2NH3(g) ΔH=-92.4 kJ·mol-1。下图甲表示在一定体积的密闭容器中反应时N2的物质的量浓度随时间的变化,图乙表示在其他条件不变的情况下,改变起始投料中H2与N2的物质的量之比(设为k)对该平衡的影响。

①已知图甲中0~t1 min内,v(H2)=0.03 mol·L-1·min-1,则t1=________ min;若从t2 min起仅改变一个反应条件,则所改变的条件可能是____________________________(填一种即可)。
②图乙中,b点时k=_________。
③已知某温度下该反应的平衡常数K=10,在该温度下向容器中同时加入下列浓度的混合气体:c(H2)=0.1 mol/L,c(N2)=0.5 mol/L,c(NH3)=0.1 mol/L,则在平衡建立过程中NH3的浓度变化趋势是__________(填“逐渐增大”“逐渐减小”或“恒定不变”)。
(3)联氨(又称肼,N2H4,无色液体)为二元弱碱,在水中的电离方式与氨相似,是一种应用广泛的化工原料,可用作火箭燃料。(已知:N2H4+H+![]() N2H5+)
N2H5+)
①N2H5+的电子式为_______。联氨与硫酸形成的酸式盐的化学式为________。
②联氨是一种常用的还原剂。向装有少量AgCl的试管中加入联氨溶液,观察到的现象___________________________________________________________。
(4)尿素(CO(NH2)2)是目前使用量较大的一种化学氮肥,工业上利用下图所示装置(阴、阳极均为惰性电极)电解尿素的碱性溶液制取氢气。
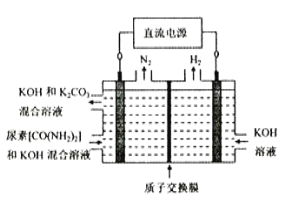
①该装置中阳极的总电极反应式为_____________________________________________。
②若两极共收集到气体22.4L(标准状况),则消耗的尿素为____________g(忽略气体的溶解)。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应A(g)+B(g) ![]() C(g)+D(g)过程中的能量变化如图所示,下列说法正确的是
C(g)+D(g)过程中的能量变化如图所示,下列说法正确的是

A. 反应物的键能总和大于生成物的键能总和
B. 升高温度,利于A的转化率增大
C. 加入催化剂时,可以降低反应热
D. 增大压强,能够缩短反应达到平衡状态的时间
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表的形式多种多样,如下图所示是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,下列说法不正确的是

A. 简单离子半径:②>⑧>⑨
B. 简单氢化物的稳定性:⑤>⑧
C. 最高价氧化物对应的水化物的酸性:⑨>⑧>⑦
D. ①与⑤可形成既含极性键又含非极性键的化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某学习小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验).

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸.
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹.
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a.
Ⅳ.
(1)A中产生黄绿色气体,其电子式是 ______;A中使用KMnO4可以在不加热的情况下与浓盐酸发生反应。如果改用二氧化锰,则在加热条件下发生的化学反应方程式为______。
(2)验证氯气的氧化性强于碘的实验现象是 ______ 。
(3)B中溶液发生反应的离子方程式是 ______ 。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 ______。
(5)过程Ⅲ实验的目的是 ______ 。
(6)实验结论:氯、溴、碘单质的氧化性逐渐 ______ ,原因是:同主族元素从上到下 ______ ,得电子能力逐渐 ______ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,请用化学用语回答下列问题:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ⑥ | ⑦ | ⑧ | |||||
3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
4 | ② | ④ |
(1)在③~⑦元素中,原子半径最大的是__________(填元素符号);
(2)⑦元素的最高价氧化物对应的水化物与其氢化物能生成盐M,M中含有的化学键类型有__________________;
(3)写出元素①和⑧的单质在加热条件下反应生成的化合物的电子式:_________。
(4
(5)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是_____________(填物质化学式);呈两性的氢氧化物是_________(填物质化学式),该化合物与NaOH溶液反应的离子方程式为___________。
(6)用电子式表示元素③与⑨形成化合物的过程_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com