
科目: 来源: 题型:
【题目】已知酸性:H2SO4>![]() >H2CO3>
>H2CO3>![]() > HCO3—,综合考虑反应物的转化率和原料成本等因素,将
> HCO3—,综合考虑反应物的转化率和原料成本等因素,将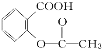 转变为
转变为![]() 的方法有
的方法有
A. 与足量的NaOH溶液共热后,再加入适量H2SO4
B. 与足量的NaOH溶液共热后,再通入足量CO2
C. 与稀H2SO4共热后,加入足量的NaHCO3溶液
D. 与稀H2SO4共热后,加入足量的Na2CO3溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,向1L恒容密闭容器中通入2mol CO2和8mol H2发生反应:CO2(g) +4H2(g)![]() CH4(g) +2H2O(g) ,5min后,测得CO2的物质的量为1.2mol ,则0~5min内用H2表示的化学反应速率是
CH4(g) +2H2O(g) ,5min后,测得CO2的物质的量为1.2mol ,则0~5min内用H2表示的化学反应速率是
A.0.16mol·L-1·min -1B.0.24mol·L-1·min -1C.0.64mol·L-1·min -1D.0.96mol·L-1·min -1
查看答案和解析>>
科目: 来源: 题型:
【题目】教材采用图1实验装置测定锌与稀硫酸反应的速率。

(1)检查图1装置气密性的操作方法是___。
(2)分别取2g颗粒大小相同的锌粒分别与体积均为40mL的1mol/L硫酸、4mol/L硫酸反应,收集25mLH2时所需时间后者比前者___。
(3)同学们在实验操作中发现本实验设计存在明显不足,例如___。
(4)某化学兴趣小组对教材实验装置进行图2所示改进。检查装置气密性后进行的实验操作有:
a.在多孔塑料袋中装入锌粒;
b.在锥形瓶中加入40mL1mol/L硫酸;
c.塞好橡胶塞,___时立即用秒表计时;
d.注射器内每增加5mL气体时读取一次秒表。
(5)实验观察到锌与稀硫酸反应初期速率逐渐加快,其原因是___,反应进行一定时间后速率逐渐减慢,原因是___。
(6)测得产生H2的体积与反应时间的关系曲线如图3所示,t1~t2时间段氢气体积略有减小的原因是___;在64s内用H+浓度表示的平均反应速率v(H+)=___(此时,溶液体积仍为40mL,气体摩尔体积为25L/mol)。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某同学为了探究锌与硫酸反应过程中的速率变化,在 400mL 稀硫酸中加入足量的锌粉,标况下用排水集气法收集反应放出的氢气,实验记录如下(累计值):
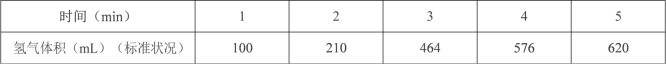
①哪一时间段反应速率最大_______min(填“0~1”、“1~2”、“2~3”、“3~4”、“4~5”), 原因是________。
②求 3~4 分钟时间段以盐酸的浓度变化来表示的该反应速率________设溶液体积不变)。
(2)该同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回 答下列问题:
①硫酸铜溶液可以加快氢气生成速率的原因是_______。
②实验室中现有 Na2SO4、MgSO4、Ag2SO4、K2SO4 等 4 种溶液,可与实验中 CuSO4 溶液起相似作用的是_______。
③要减慢上述实验中气体产生速率,可采取的合力措施有_______、_______(答两种)。
(3) 某温度下在 4 L 密闭容器中,X、Y、Z 三种气态物质的物质的量随时间变化曲线如图。
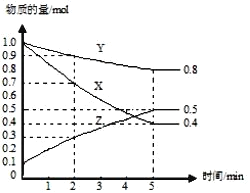
①该反应的化学方程式是_______。
②该反应达到平衡状态的标志是_______(填字母)
A.Y 的体积分数在混合气体中保持不变 B.X、Y 的反应速率比为 3:1
C.容器内气体压强保持不变 D.容器内气体的总质量保持不变E.生成 1 mol Y 的同时消耗 2 mol Z
③2 min 内 Y 的转化率为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】以NaCl为主要成分的融雪剂会腐蚀桥梁、铁轨等钢铁设备。某研究小组探究NaCl溶液对钢铁腐蚀的影响。
(1)将滤纸用3.5%的NaCl溶液润湿,涂上铁粉、碳粉的混合物,贴在表面皿上。在滤纸上加几滴检验试剂,再缓慢加入NaCl溶液至没过滤纸,操作如下所示:

①实验ⅰ的现象说明,得电子的物质是_______________________________。
②碳粉的作用是___________________________________________________。
③为了说明NaCl的作用,需要补充的对照实验是_____________________。
(2)向如图示装置的烧杯a、b中各加入30mL 3.5%的NaCl溶液,闭合K,指针未发生偏转。加热烧杯a,指针向右偏转。

①取a、b中溶液少量,滴加K3[Fe(CN)6]溶液,a中出现蓝色沉淀,b中无变化,b中铁片作________极。
②加热后,指针发生偏转的原因可能是_____________________。
(3)用(2)中图示装置探究不同浓度NaCl溶液对钢铁腐蚀的影响,向烧杯a、b中各加入30mL不同质量分数的NaCl溶液,实验记录如下表所示。
实验 | a | b | 指针偏转方向 |
I | 0.1% | 0.01% | 向右 |
II | 0.1% | 3.5% | 向左 |
Ⅲ | 3.5% | 饱和溶液 | 向右 |
①Ⅱ中,b中电极发生的电极反应式是_______________________________。
②Ⅲ中,铁在饱和NaCl溶液中不易被腐蚀。查阅资料可知:在饱和NaCl溶液中O2浓度较低,钢铁不易被腐蚀。设计实验证明:_______________________________。
(4)根据上述实验,对钢铁腐蚀有影响的因素是_______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表列出了①~⑩十种元素在周期表中的位置。
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ④ | ⑩ | |||||
3 | ⑤ | ⑥ | ⑦ | ③ | ⑧ | ⑨ | ||
回答下列问题:
(1)①、④按原子个数比1:1 组成的分子的电子式为____________________ ;由②、④两种元素组成的一种无毒化合物的结构式为 _____________________。
(2)这10种元素中,化学性质最不活泼的元素是_____________(填元素符号,下同),得电子能力最强的原子是__________________,失电子能力最强的单质与水反应的化学方程式是_________________________。
(3)用化学方程式表示②和⑨两种元素的非金属性强弱:________________________ 。
(4)元素③的气态氢化物和元素⑧的气态氢化物中,易于制备的是 ____________________(填化学式)
(5)元素⑤的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应,其离子方程式为 ______________________________。
(6)元素 ①、④、⑤两两之间可以形成两种类型的化合物,写出一种共价化合物的化学式:___________________ ;写出一种离子化合物的化学式:______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以A(C2H2)为原料合成食用香料E和吡咯(pyrrole)的路线如图所示,部分反应条件及产物略去。其中D在一定条件下可被氧化成酮。
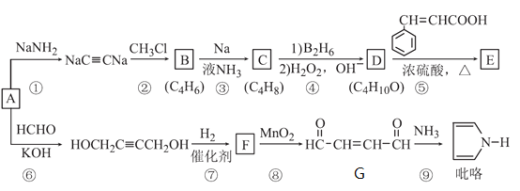
回答下列问题:
(1)A的官能团名称是_______________;C的名称是_______________;
(2)⑥的反应类型是_______________。⑧的反应类型是_______________。
(3)反应⑤的化学方程式为____________________________。
(4)满足下列条件的肉桂酸(![]() )的同分异构体共有_________种(不考虑立体异构):①含有苯环 ②能让溴的四氯化碳溶液褪色 ③能水解。与G互为同分异构体,且核磁共振氢谱只有一组峰的有机物的结构简式是________。(任写一种)
)的同分异构体共有_________种(不考虑立体异构):①含有苯环 ②能让溴的四氯化碳溶液褪色 ③能水解。与G互为同分异构体,且核磁共振氢谱只有一组峰的有机物的结构简式是________。(任写一种)
(6)参照上述合成路线,设计一条由A和乙醛为起始原料制备2,5-二甲基吡咯(![]() )的合成路线_________________________________。
)的合成路线_________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下列各组化合物中,化学键类型和化合物类型均相同的是_________(填序号)。
A.CaCl2和 Na2S B.Na2O 和 Na2O2
C.CO2和CaO D.HC1 和 NaOH
(2)已知1 mol石墨转化为1 mol金刚石要吸收能量,则1 mol石墨的能量比1 mol金刚石的能量____(填“高”或“低”),石墨比金刚石_______(填“稳定”或“不稳定”)。
(3)Ba(OH)2 8H2O和NH4Cl反应的化学方程式是____________,该反应是___(填“吸热”或“放热”)反应,反应过程能量变化的图像符合_____________(填“图1”或“图2”)。
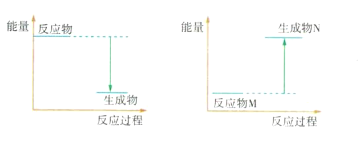
图1 图2
(4)如图3所示,把试管放入盛有饱和澄清石灰水(温度为25℃)的烧杯中,先在试管中放入几小块镁片,再用滴管滴入5mL盐酸。可以观察到烧杯中的石灰水逐渐由澄清变浑浊,出现这种现象的原因是___________________________。
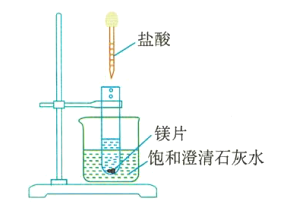
图3
查看答案和解析>>
科目: 来源: 题型:
【题目】Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如图。该电池工作时,下列说法正确的是( )
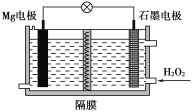
A.Mg电极是该电池的正极B.H2O2在石墨电极上发生氧化反应
C.石墨电极附近溶液的碱性增强D.溶液中Cl-向正极移动
查看答案和解析>>
科目: 来源: 题型:
【题目】反应2NO(g)+2H2(g)![]() N2(g)+2H2O(g)中,每生成7gN2放出166kJ的热量,该反应的速率表达式为:υ=k·c m(NO)·cn(H2)(k、m、n待测),其反应包含下列两步:①2NO+H2=N2+H2O2(慢) ②H2O2+H2=2H2O(快)T℃时测得有关实验数据如下:
N2(g)+2H2O(g)中,每生成7gN2放出166kJ的热量,该反应的速率表达式为:υ=k·c m(NO)·cn(H2)(k、m、n待测),其反应包含下列两步:①2NO+H2=N2+H2O2(慢) ②H2O2+H2=2H2O(快)T℃时测得有关实验数据如下:

下列说法错误的是
A. 该反应速率表达式:υ=5000·c2(NO)·c(H2)
B. 整个反应速率由第①步反应决定
C. 正反应的活化能:①<②
D. 该反应的热化学方程式为2NO(g)+2H2(g)=N2(g)+2H2O(g) △H=-664kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com