
科目: 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O设计的电池装置如图所示,该装置既能有效消除氮氧化物的排放减轻环境污染,又能充分利用化学能。下列说法正确的是
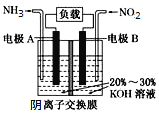
A.电极A上发生氧化反应,电极A为正极
B.电池工作时,OH—从右向左迁移
C.当有0.1molNO2被处理时,外电路中通过电子0.4mol
D.电极B的电极反应式为2NO2+8e—+8H+=N2+4H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列是乙酸乙酯的制备、分离、提纯、性质验证的实验装置,下列有关说法正确的是

选项 | 功能 | 装置 | 实验的操作或评价 |
A | 制备 | a | 试管中NaHCO3溶液的作用:反应掉挥发的乙酸,溶解乙醇,有利于乙酸乙酯的收集 |
B | 蒸馏 | b | 应把温度计插入液面以下,以便准确测出各馏分的温度 |
C | 分液 | c | 打开分液漏斗的旋塞,让乙酸乙酯缓缓流入烧杯中 |
D | 水解 | d | 碱性条件下水解完全的标志为溶液不再分层 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】不同条件下,用O2氧化一定浓度的FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测不合理的是

A. Fe2+的氧化率随时间延长而逐渐增大
B. 由②和③可知,pH越大,Fe2+氧化速率越快
C. 由①和③可知,温度越高,Fe2+氧化速率越快
D. 氧化过程的离子方程式为:4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】取软锰矿石(主要成分为MnO2)116g 跟足量浓盐酸发生如下反应(杂质不参与反应)MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,制得22.4L Cl2(标准状况)。下列有关说法中不正确的是
MnCl2+Cl2↑+2H2O,制得22.4L Cl2(标准状况)。下列有关说法中不正确的是
A.这种软锰矿石中MnO2的质量分数为75%
B.被氧化的HCl的物质的量为4mol
C.参加反应的HCl的质量为146g
D.被还原的MnO2的物质的量为1mol
查看答案和解析>>
科目: 来源: 题型:
【题目】高纯活性氧化锌可用于光催化、光电极、彩色显影等领域。以工业级氧化锌(含Fe2+、Mn2+、Cu2+、Ni2+、Cd2+等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:

已知Ksp[Fe(OH)3]=4.0×10-38。
回答下列问题:
(1)浸出时,为了提高浸出效率可采用的措施有(写两种):___________;___________。
(2)氧化时,加入KMnO4溶液是为了除去浸出液中的Fe2+和Mn2+(溶液中Mn全部转化为MnO2),请配平下列除去Fe2+的离子方程式:MnO![]() +Fe2++ ===MnO2↓+Fe(OH)3↓+H+ ____________
+Fe2++ ===MnO2↓+Fe(OH)3↓+H+ ____________
(3)加入锌粉的目的是_______________________________________________________。
(4)已知H2SO4浸出液中,c(Fe2+)=5.04 mg·L-1、c(Mn2+)=1.65 mg·L-1,加入KMnO4溶液反应一段时间后,溶液中c(Fe3+)=0.56 mg·L-1,若溶液pH=3,则此时Fe3+__________(填“能”或“不能”)生成沉淀。
(5) 已知:常温下,①Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11;②H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH的变化关系如图所示。

①比较H2R ,HR-,H2CO3三者的酸性强弱_________________________________
②NaHR溶液中存在![]() = _______________________
= _______________________
查看答案和解析>>
科目: 来源: 题型:
【题目】欲测定某NaOH溶液的物质的量浓度,可用0.1000 mol·L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂)。请回答下列问题:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握______________的活塞,右手摇动___________,眼睛注视________________,直到加入最后一滴盐酸时,溶液由______色变为______色,并_____________________为止。
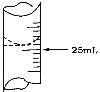
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10 mL,滴定后液面如图,则此时消耗标准溶液的体积为____________。
(3)乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000 mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.11 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 0.22 | 26.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为________(小数点后保留四位)。
(4)下列哪些操作会使测定结果偏高_________(填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
查看答案和解析>>
科目: 来源: 题型:
【题目】酮洛芬是一种良好的抗炎镇痛药,可以通过以下方法合成:

(1)酮洛芬中含氧官能团的名称为______________和______________。
(2)由B→C的反应类型是____________________。
(3)写出D→E反应的化学方程式______________________________________________。
(4)写出同时满足下列条件的A的一种同分异构体的结构简式_____________________。
Ⅰ.能发生银镜反应
Ⅱ.水解产物之一遇FeCl3溶液显色
Ⅲ.分子中含有4种不同化学环境的氢原子
(5)请写出以甲苯和乙醇为原料制备化合物![]() 的合成路线流程图(无机试剂可任选)________________。
的合成路线流程图(无机试剂可任选)________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋中有丰富的资源,下图为海水资源利用的部分过程。
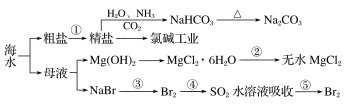
下列有关说法正确的是
A.工业上通过电解饱和MgCl2溶液制取金属镁
B.含氮、磷的大量废水排入海洋,易引发赤潮
C.反应④的离子方程式为:Br2+SO2+2H2O=2HBr+2H++ SO42-
D.在第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入药品的顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物的结构可用“键线式”表示,如:CH3-CH=CH-CH3可简写为 ![]() 。松油醇具有紫丁香味,其酯类常用于香精调制,如图为松油醇的结构,以下关于它的说法正确的是
。松油醇具有紫丁香味,其酯类常用于香精调制,如图为松油醇的结构,以下关于它的说法正确的是
![]()
A.分子式为C10H19O
B.属于芳香烃
C.能发生取代、加成、氧化
D.与氢气加成后的产物有4种一氯化物
查看答案和解析>>
科目: 来源: 题型:
【题目】三聚氰胺含氮量较高,但对人体有害。一些不法乳制品企业为了提高乳制品中蛋白质含量,向乳制品中添加三聚氰胺,使儿童患肾结石。下图所示的实验装置可用来测定三聚氰胺的分子式。

已知三聚氰胺的相对分子质量为126。取1.26 g三聚氰胺样品,放在纯氧中充分燃烧,生成CO2、H2O、N2,实验测得装置B增重0.54 g,C增重1.32 g,排入F中水的体积为672 mL(可按标准状况计算)。
(1)E装置的作用是________________________。
(2)需要加热的装置是____________(填字母)。
(3)装置D的作用是_________________________。
(4)F处读数时应该注意:_________________、__________________。
(5)三聚氰胺的分子式为___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com