
科目: 来源: 题型:
【题目】按要求答题:
(1)金属焊接时可用NH4Cl溶液作除锈剂的原因(用离子方程式回答)_____________________________。
(2)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=_____________mol·L-1(填精确值)。
(3)常温下,将pH=a的NaOH溶液与pH=b的醋酸溶液等体积混合后,两者恰好完全反应,则该温度下醋酸的电离平衡常数约为_______________________(用含代数a、b等表示)。
(4)常温,PH=5 的H2SO4溶液加水稀释至原溶液体积的1000倍,求稀释后溶液中c(H+):c(SO42-)=________
(5)已知:H2CO3的电离平衡常数 K1=4.4×10-7 ; K2=4.7×10-11,HClO的电离平衡常数K=3.0×10-8,则将少量CO2气体通入NaClO溶液中的离子方程式____________________
(6)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为_____________________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是
①H2O2分子中既含极性键又含非极性键
②若R2-和M+的电子层结构相同,则原子序数:R>M
③F2、Cl2、Br2、I2熔点随相对分子质量增大而升高
④NCl3、CCl4、CO2、BeCl2分子中各原子均达到8电子稳定结构
⑤固体熔化成液体的过程是物理变化,所以不会破坏化学键
⑥HF分子很稳定是由于HF分子之间能形成氢键
⑦Na2O2固体中的阴离子和阳离子个数比是1:2
⑧由于非金属性Cl>Br>I,所以酸性HCl>HBr>HI
A.②④⑤⑥⑧B.①③④⑤C.②④⑤⑦D.③⑤⑦⑧
查看答案和解析>>
科目: 来源: 题型:
【题目】苯达莫司汀是一种抗癌药物。其中一种合成苯达莫司汀中间体H的路线如图:

已知:RCH== CHR’![]() RCOOH+R’COOH
RCOOH+R’COOH
(1)C的命名是____,H中含氧官能团是___(填名称)。
(2)E的结构简式是______,C到D的反应类型是______。
(3)写出B→C的化学方程式:______。
(4)M是 的同分异构体,M能发生银镜反应,和NaHCO3反应产生气体,M可能有___种,若分子中只有3种不同化学环境的氢,则符合条件的M的结构简式是_____。
的同分异构体,M能发生银镜反应,和NaHCO3反应产生气体,M可能有___种,若分子中只有3种不同化学环境的氢,则符合条件的M的结构简式是_____。
(5)请写出以![]() 和适当的无机试剂为原料制备
和适当的无机试剂为原料制备![]() 的合成路线流程图:_____。
的合成路线流程图:_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】元素R、T、X、Y、Z在元素周期表中的相对位置如图所示,其中Z单质与H2混合遇强光会发生爆炸。则下列判断错误的是

A.气态氢化物的沸点:H2T>H2Y>H2R
B.R与Y的电子数相差8
C.非金属性:Z>Y>X
D.Z的含氧酸的酸性比Y的强
查看答案和解析>>
科目: 来源: 题型:
【题目】侯氏制碱法又称联合制碱法,是我国化学工程专家侯德榜于1943年发明的。此方法具有食盐利用率高、对环境的污染少、生产成本低等优点。其制备中涉及如下两个反应:NaC1+H2O+CO2+NH3===NaHCO3↓+NH4Cl、2NaHCO3![]() Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。
(1)基态氯原子的电子排布式为___,基态氮原子最高能级上电子自旋方向均相同,这是由____规则(原理)确定的,C、N、O三种元素第一电离能由大到小的顺序为____。
(2)H2O、CO2、NH3三种分子中,中心原子的杂化轨道类型为sp的是___,属于V形分子的是____。在常温常压下,1体积水可溶解700体积NH3、可溶解0.8体积CO2,试解释其原因:_____。
(3)要确定Na2CO3固体是晶体还是非晶体,最可靠的方法是___,下列事实不能支持Na2CO3的晶体类型为离子晶体的是___(填字母)。
a.熔点为851℃ b.晶体中存在Na+、CO32-
c.可溶于水 d.晶体中存在离子键,共价键
(4)钠、氧两元素可形成两种常见化合物,其中一种的晶胞如下图所示(图中微粒表示相应的结构微粒),则该氧化物的化学式为___,若晶胞参数为d pm,晶胞的密度为![]() ,则阿伏加德罗常数NA=___(用含d、
,则阿伏加德罗常数NA=___(用含d、![]() 的代数式表示)。
的代数式表示)。

查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用0.10 mol·L-1 NaOH溶液分别滴定20.00 mL浓度均为0.10 mol·L-1 CH3COOH溶液和HCN溶液,所得滴定曲线如下图。下列说法正确的是

A. 点①和点②所示溶液中:c(CH3COO-)<c(CN-)
B. 点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C. 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
D. 点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“![]() ”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的Ts核素符号是![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2回收与利用是环境科学家研究的热点课题。利用CO2制备合成气(CO、H2),再制备高值产品,如甲醇等,也可以利用CO2直接制备甲醇等产品。
(1)已知几种反应的正反应活化能(E1)、逆反应活化能(E2)如表所示:
序号 | 化学反应 | E1/(kJ·mol-1) | E2/(kJ·mol-1) |
① | 2CO(g)+O2(g)===2CO2(g) | 1954 | 2519 |
② | H2(g)+ | 685 | 970 |
③ | 2CH3OH(g)+3O2(g)===2CO2(g)+4H2O(l) | 3526 | 4978 |
在相同条件下,起始反应最快的是____(填序号)。由H2和CO合成气态甲醇的热化学方程式为________。
(2)T1℃下,在2L恒容密闭容器中充入0.20mol CO和0.60mol H2合成CH3OH,发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H<0,经5min恰好达到平衡,CH3OH的浓度是0.05mol·L-1。
CH3OH(g) △H<0,经5min恰好达到平衡,CH3OH的浓度是0.05mol·L-1。
①T1℃时,以H2表示的反应的平均速率为___,平衡常数K=____。
②(T1+100)℃时,在1L恒容密闭容器中充入0.10molCO、0.20molH2和0.30mol CH3OH,此时反应将____(填“向左移动”“向右移动”“达到平衡”或“无法判断”)。
(3)CO2和H2在催化剂作用下反应,可以直接合成甲醇:CO(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0,测得相同时间内甲醇产率与温度的关系如图所示。
CH3OH(g)+H2O(g) △H<0,测得相同时间内甲醇产率与温度的关系如图所示。
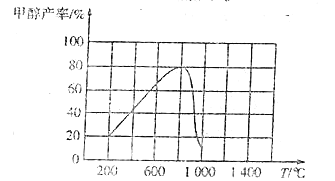
①温度在800℃时甲醇产率最高的主要原因是/span>____。
②下列措施能提高CO2平衡转化率的是____(填字母)。
A.升温 B.加压 C.加入催化剂 D.增大H2浓度
(4)利用电解法在酸性条件下将CO2和H2O转化或CO和H2,阴极反应式之一为CO2+2e-+2H+=CO+H2O,其机理如下:①CO2+2e-+H2O===CO+2OH-(慢反应);②OH-+CO2=HCO3-(快反应);③HCO3-+H+=CO2+H2O(快反应)。其中水的作用是___;控制阴板反应速率的反应是___(填序号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋是一个巨大的资源宝库。在海洋中生长的海带,富含碘元素。某同学设计以下实验方案,从海带中提取I2。
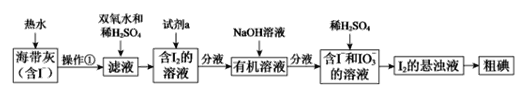
(1)灼烧海带时,除需酒精灯与三脚架外,还需要用到的实验仪器是___。
(2)向滤液中加入双氧水和稀硫酸发生反应的离子方程式是__________。
(3)试剂a可以是_________(填序号)。
A 酒精 B 四氯化碳
C 裂化汽油 D 苯
(4)I-和IO3-在酸性条件下生成I2的离子方程式是__________。
(5)上图中,含I2的溶液经3步转化为I2的悬浊液,其目的是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将Na2A和NaHA溶液分别进行稀释,若-lg c(Na+)=pNa、-lgc(OH-)=pOH,则测得两种溶液中pNa与pOH的关系曲线如图。下列说法正确的是( )
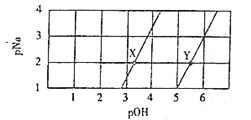
A. X点所在的直线表示NaHA溶液的稀释
B. 在Y点加入适量NaOH固体可以达到X点
C. 将X和Y点溶液等体积混合,则有c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
D. 常温下,H2A的Ka1数量级为10-5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com