
科目: 来源: 题型:
【题目】海水蕴含着丰富的资源。在化学实验室里模拟从海水中提取重要的工业原料时,设计了以下操作流程:
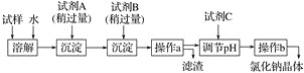
请回答以下问题:
(1)在所提供的试剂中选择:试剂B是____。
①Na2CO3 ②BaCl2 ③稀盐酸
(2)操作b中用到的主要仪器为酒精灯、____、三脚架和玻璃棒。

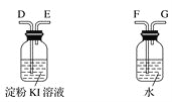
(3)利用所得的氯化钠制氯气和氢气,并检验氯气的氧化性和测定产生氢气的体积。试按上图所给仪器,设计一套能完成以上实验目的装置,仪器接口的正确连接顺序是:
A接___,___接____;B接____,____接____。
(4)电解氯化钠溶液时的离子方程式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】NA代表阿伏加德罗常数,下列说法正确的是
A. 1L1mol/LMgCl2溶液中含有的Mg2+离子数为NA
B. 100 mL 2.0 mol/L的盐酸与醋酸溶液中氢离子均为0.2NA
C. 0.1mol/L稀硫酸中含SO42- 的数目为0.1NA
D. 标准状况下,11.2LNO和5.6LO2混合后,分子总数小于0.5NA
查看答案和解析>>
科目: 来源: 题型:
【题目】五氧化二碘(I2O5)可用作氧化剂,除去空气中的一氧化碳,易溶于水形成碘酸,不溶于无水乙醇、乙醚、氯仿和二硫化碳。用下列装置制备五氧化二碘(加热装置及夹持装置省略)。

制备五氧化二碘的步骤如下:
步骤1:I2与KClO3按一定比例加入反应器M中,用硝酸调节pH=1~2,温度控制在80~90℃,搅拌反应1h,使反应完全。
步骤2:然后冷却至室温,析出碘酸氢钾晶体。将过滤得到的晶体加水、加热溶解,并用足量氢氧化钾溶液中和至溶液pH为10。再冷却结晶,过滤得到的晶体于118℃干燥3h,得到碘酸钾产品。
步骤3:将步骤2制得的碘酸钾酸化后得碘酸(HIO3),再将碘酸在干燥空气气流中加热到200℃失水得到五氧化二碘。
(1)五氧化二碘可除去空气中的一氧化碳,反应生成碘单质,该反应中氧化剂与还原剂的物质的量之比为___。
(2)仪器M的名称是___。
(3)步骤1中除了生成碘酸氢钾[KH(IO3)2]外,同时还生成氯化钾和氯气,若n(KCl):n(C12)=5:3,写出该反应的化学方程式:___,该反应中的氧化剂是___(填化学式)。
(4)反扣的漏斗N除了可以防止倒吸,还有一个作用是____,NaOH溶液的作用是___。
(5)步骤2中的主要反应为KH(IO3)2+KOH===2KIO3+H2O,称取0.550g碘酸钾产品(假设杂质不参与反应),将产品放入烧杯中,加蒸馏水溶解,并加入足量酸化的KI溶液,配制成100mL溶液,取10.00mL配制的溶液于锥形瓶中并加入指示剂,然后用0.1mol·L-1 Na2S2O3标准溶液滴定至终点,三次实验平均消耗标准溶液的体积为15.00mL。(已知I2+2Na2S2O3=2NaI+Na2S4O6)
①该滴定选择的指示剂是_____。
②该碘酸钾产品中碘酸钾的质量分数是____%(保留三位有效数字)。
③若装Na2S2O3标准溶液的滴定管没有用Na2S2O3标准溶液润洗,则所测得产品的质量分数___(填“偏高”或“偏低”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
A. 2H2(g)+O2(g) == 2H2O(1) △H= ―285.8kJ/mol![]()
B. 2H2(g)+ O2(g) == 2H2O(1) △H= +571.6 kJ/mol
C. 2H2(g)+O2(g) == 2H2O(g) △H= ―571.6 kJ/mol
D. H2(g)+1/2O2(g) == H2O(1) △H= ―285.8kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下在一容积不变的密闭容器中发生可逆反应2X(g)![]() Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是
Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是
A.混合气体的密度不再变化B.反应容器中Y的质量分数不变
C.体系压强不再变化D.c(X):c(Y):c(Z)=2:1:1
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学实验小组从商店买回的浓硫酸试剂标签的部分内容破损。由于试剂瓶口密封签已破损,他们怀疑该硫酸的质量分数与标签不符,决定开展研究。部分破损标签内容为硫酸:化学纯(CP) 品名:硫酸, 化学式:H2SO4相对分子质量:98,质量分数:98% 密度:1.84g/cm3。甲同学认为,可以用一种精密仪器测量该溶液的c(H+),若c(H+)=36.8 mol·L-1,则该溶液的质量分数为98%。乙同学认为,即使有精密的仪器,甲同学的方案也不行,建议用重量分析法来测定。具体设想:取一定体积的该硫酸与足量氯化钡溶液反应,过滤、洗涤、干燥沉淀,称量沉淀的质量。丙同学则建议用中和滴定法进行测定,设想如下:①准确量取一定体积的硫酸,用适量的水稀释;②往稀释后的溶液中滴入几滴指示剂;③用碱式滴定管量取标准浓度的氢氧化钠溶液滴定,直到出现滴定终点为止;④记录消耗的氢氧化钠溶液的体积。
请回答下列问题:
(1)乙同学推测甲同学的方案不可行的理由是_____________________________________
(2)乙同学的方案的关键操作有两点:①确保SO42-完全沉淀;②洗涤沉淀,确保沉淀不含杂质。在实际中,请设计简单实验检验SO42-是否完全沉淀:____________________________
检验沉淀是否洗净的操作方法是__________________________________________________;
(3)在丙同学的方案中步骤②用到的指示剂是____________;达到滴定终点的标志是______________________________________________________________________________。
(4)丙同学的方案中,下列操作使测定结果偏小的是_____________。
①在滴定前未用NaOH标准溶液润洗滴定管,②滴定前滴定管尖嘴部分有气泡,滴定后滴定管尖嘴部分仍有气泡,③锥形瓶用蒸馏水洗净后,没有用待测液润洗,④滴定前,仰视读数,滴定后,仍仰视读数,⑤滴定前,仰视读数,滴定后,俯视读数
(5)丙同学在实验中,分别取等体积原硫酸,用NaOH溶液滴定三次,终点时,得到的NaOH溶液体积如下表所示:
实验序号 | 硫酸体积 | NaOH溶液体积 | NaOH溶液浓度 |
① | 5.00 mL | 35.65 mL | 5.00 mol·L-1 |
② | 5.00 mL | 39.65 mL | 5.00 mol·L-1 |
③ | 5.00 mL | 35.55 mL | 5.00mol·L-1 |
通过计算,该浓硫酸物质的量浓度为____________________________________________。是否与标签上表示的溶质质量分数相同___________(填“是”或“否”)
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭系统中有反应C(s)+CO2(g) ![]() 2CO(g),能使反应速率加快的措施是
2CO(g),能使反应速率加快的措施是
①通过减小容器体积增大压强 ②升高温度 ③将炭粉碎 ④通入CO2 ⑤增加炭的量 ⑥恒容条件下通入N2使得压强增大
A. ①②③⑥B. ①②④⑥C. ①②③④D. ①②③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】将纯净的A置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:A(s)![]() 2B(g)+C(g)+D(g)。下列说法正确的是
2B(g)+C(g)+D(g)。下列说法正确的是
A.2v(B)=v(C)
B.增大A的物质的量,化学反应速率加快
C.若B的质量分数不变,则反应达平衡
D.平衡后移除C,A的转化率增大
查看答案和解析>>
科目: 来源: 题型:
【题目】H2和 I2在一定条件下能发生反应:H2(g)+I2(g)![]() 2HI(g),1 mol H2 完全反应放出 akJ热量。已知:(a、b、c 均大于零)。下列说法不正确的是
2HI(g),1 mol H2 完全反应放出 akJ热量。已知:(a、b、c 均大于零)。下列说法不正确的是
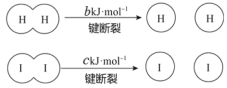
A.反应物的总能量高于生成物的总能量
B.断开 1 mol H—H 键和 1 mol I—I 键所需能量大于断开 2 mol H—I 键所需能量
C.断开 2 mol H—I 键所需能量约为(c+b+a)kJ
D.向密闭容器中加入 2 mol H2 和 2 mo l I2,充分反应放出的热量小于 2a kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H=—1214 kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H= —566kJ/mol
则表示甲烷燃烧热的热化学方程式____________________________________________。
(2)氢气、甲烷、甲醇是优质的清洁燃料,可制作燃料电池。
某同学利用甲烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是___________(填序号)

A.电源中的a一定为正极,b一定为负极
B.不能用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++ 2e-= H2↑
(3)生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)

①一定条件下CH4的平衡转化率与温度、压强的关系如图,则Pl_________P2;A、B、C三点处对应平衡常数(KA、KB、KC)的大小顺序为___________(填“<”、“>”“=”)
②100℃时,将1mol CH4和2mol H2O通入容积为10L的反应室,反应达平衡的标志是:_______
a.容器的压强恒定
b.单位时间内消耗0.1mol CH4同时生成0.3mol H2
c.容器内气体密度恒定
d.3v(CH4)=v(H2)
e. 容器内气体平均相对分子质量恒定
③如果将1mol CH4和2mol H2O通入容积为10L的反应室达到平衡时CH4的转化率为50%,则100℃时该反应的平衡常数K=___________。
(4)已知2H2(g)+CO(g)![]() CH3OH(g)△H=-akJmol-1(a>0),在一个容积固定的容器中加入2mol H2和1mol CO,在500℃时充分反应,达平衡后CH3OH的浓度为W molL-1。反应平衡后,若向原来容器中再加入2mol H2和1mol CO,500℃充分反应再次达平衡后,则CH3OH浓度___________2WmolL-1(填“>”、“<”或“=”)。
CH3OH(g)△H=-akJmol-1(a>0),在一个容积固定的容器中加入2mol H2和1mol CO,在500℃时充分反应,达平衡后CH3OH的浓度为W molL-1。反应平衡后,若向原来容器中再加入2mol H2和1mol CO,500℃充分反应再次达平衡后,则CH3OH浓度___________2WmolL-1(填“>”、“<”或“=”)。
(5)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图所示的电池装置,
①负极的电极反应式为___________,
②用该原电池做电源,用惰性电极电解200mL饱和食盐水(足量),消耗标准状况下的CO 224mL,则溶液的pH=___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com