
科目: 来源: 题型:
【题目】请按要求回答下列问题:
(1)氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。已知:2C(s)+O2(g)=2CO(g)△H=-22lkJ/mol,
C(s)+O2(g)=CO2(g)△H=-393.5 kJ/mol,
N2(g)+O2(g)=2NO(g)△H=+181 kJ/mol,
则:2CO(g)+2NO(g)![]() N2(g)+2CO2(g)△H=__kJ/mol;
N2(g)+2CO2(g)△H=__kJ/mol;
下列措施能够增大此反应中NO的转化率的是___(填字母序号)
a.增大容器的体积 b.降低温度 c.增大CO的浓度 d.增大NO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g)△H=-574.5kJ/mol;NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g)△H=-574.5kJ/mol;NO和N2的物质的量变化如下表所示。
物质的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min | |
NO | 2.0 | 1.20 | 0.70 | 0.70 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.40 | 0.65 | 0.65 | 0.75 | 0.80 | 0.80 |
①0~5min内,以NO表示的该反应速率υ(NO)=__________,该条件下的平衡常数K=___________(保留2位小数)。
②第15min后,温度调整到T2,数据变化如上表所示,则T1___________T2(填“>”、“<”或“=”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-6mol·L-1)时,溶液中c(Ag+)为__mol·L-1,此时溶液中c(CrO42-)等于____mol·L-1。(已知Ksp(Ag2CrO4)=2.0×10-12,Ksp(AgCl)=2.0×10-10)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在下列各变化中,反应①为常温下的反应,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,E常温下为无色无味的液体,F为淡黄色粉末,G为常见的无色气体。
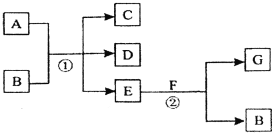
回答下列问题:
(1)A、G的化学式分别为________________、 ________________。
(2)F和E反应的化学方程式为____________________________。
(3)写出反应①的化学方程式____________________________________。
(4)在反应②中,每生成2.24 L气体G(标准状况)时,消耗F ___________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)浓硫酸与木炭粉加热反应的化学方程式为:________________。
(2)试用下图中所列各装置设计一个实验,验证上述反应所产生的各种产物。这种装置的连接顺序(按产物气流从左到右的方向)是(填图中装置的编号):_______→________→________→________。
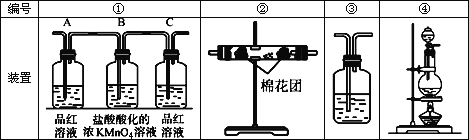
(3)实验时可观察到装置①中,A瓶的溶液褪色,C瓶的溶液不褪色。
A瓶溶液的作用是:___________________________________,
B瓶溶液的作用是_____________________________________,
C瓶溶液的作用是_____________________________________。
(4)装置②中所加的白色固体药品是_____________,可验证的产物是____________。
(5)装置③中所盛的溶液是__________________,可验证的产物是_____________。
(6)在各装置所盛的试剂不变的条件下,若装置的连接顺序为④→①→②→③,则可以检出的产物是_______________填化学式,下同),不能检出的产物是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】原子序数由小到大排列的五种短周期元素X、Y、Z、M、W,其中X是在周期表中原子半径最小的元素,Z 的最外层电子数是内层的3倍,Y、Z左右相邻,Z、W位于同主族,M与W同周期,且与X同主族。
(1)M元素是_______(填元素符号)。
(2)Z、W形成的气态氢化物中,较稳定的是_______(填化学式)。
(3)写出M2Z2的电子式:_______。
(4)由X、Y、Z、W四种元素中的三种组成的一种强酸,其稀溶液能与铜反应,离子方程式为_______。
(5)由X、Y、Z、W四种元素组成的一种离子化合物A,已知:
①1molA能与足量NaOH热的浓溶液反应生成标准状况下44.8L气体;
②A能与盐酸反应产生气体B,该气体能使品红溶液退色。
写出①中反应的化学方程式:_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学实验小组同学利用以下装置制备氨气,并探究氨气的性质(部分仪器已略去)。

请回答:
(1)该同学用镊子夹取湿润的红色石蕊试纸靠近试管口,可观察到试纸变蓝,该现象说明氨气溶于水,溶液呈___性。
(2)收集氨气时,请你选择氨气的进气口___(“a”或“b”)。
(3)若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气具有的性质是___。
(4)以下装置(盛放的液体均为水)可用于吸收多余氨气的是___(填序号)。
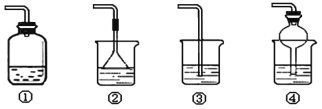
查看答案和解析>>
科目: 来源: 题型:
【题目】为了测定含氰废水中CN-的含量,某化学小组利用如图所示装置进行实验。关闭活塞a,将100 mL含氰废水与过量NaClO溶液置于装置B的圆底烧瓶中充分反应后,打开活塞b,滴入稀硫酸,然后关闭活塞b。
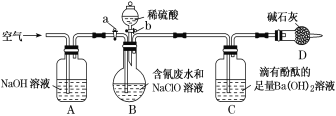
已知B中发生反应:CN-+ClO-===CNO-+Cl-、2CNO-+2H++3ClO-==N2↑+2CO2↑+3Cl-+H2O;
(1)装置D的作用是____。
(2)反应过程中,装置C中的实验现象为_____。
(3)待装置B中反应结束后,打开活塞a,缓慢通入一段时间的空气,目的是____。
(4)反应结束后,装置C中生成59.1mg沉淀,则废水中c(CN-)=___mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加入等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是
A. 甲、乙中都是铝过量 B. 甲中铝过量,乙中碱过量
C. 甲中酸过量,乙中铝过量 D. 甲中酸过量,乙中碱过量
查看答案和解析>>
科目: 来源: 题型:
【题目】稀土元素是指元素周期表中原子序数为57到71的15种镧系元素,以及与镧系元素化学性质相似的钪(Sc)和钇(Y)共17种元素。稀土元素有“工业维生素”的美称,如今已成为极其重要的战略资源。
(1)钪(Sc)为21号元素,基态原子电子排布式为____。
(2)离子化合物Na3[Sc(OH)6]中,存在的化学键除离子键外还有__。
(3)Sm(钐)的单质与l,2-二碘乙烷可生成乙烯:Sm + ICH2CH2I →SmI2+ CH2=CH2。
则lmol CH2=CH2中含有的σ键数目为___。(用NA表示阿伏伽德罗常数的值)
(4)与N3-互为等电子体的分子有___(写其中一个的化学式即可)。
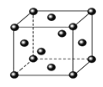
(5)Ce(铈)单质为面心立方晶体,其晶胞参数a=516pm。Ce(铈)原子的配位数为___,列式表示Ce(铈)单质的密度:___g/cm3(用NA表示阿伏伽德罗常数的值,不必计算出结果)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列根据实验事实得出的结论错误的是( )
实验事实 | 结论 | |
A. | 某溶液中加入BaCl2溶液有白色沉淀生成 | 该溶液中一定含有SO42- |
B. | 加热时,铜能与浓硫酸反应 | 浓硫酸有强氧化性 |
C. | 某分散系具有丁达尔效应 | 该分散系是胶体 |
D. | Al(OH)3既能与盐酸反应,也能与NaOH溶液反应 | Al(OH)3是两性氢氧化物 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:
Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH1=+489.0 kJ·mol-1,
C(s) +CO2(g)=2CO(g) ΔH2=+172.5kJ·mol-1
则CO(g)还原Fe2O3(s)的热化学方程式为____。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:_____。
(3)将CO2和H2充入1L的密闭容器中,在两种温度下发生反应:
CO2(g) +3H2(g)![]() CH3OH(g) +H2O(g)测得CH3OH的物质的量随时间的变化见图1。
CH3OH(g) +H2O(g)测得CH3OH的物质的量随时间的变化见图1。
①该反应的平衡常数表达式为K=___。
②曲线I、Ⅱ对应的平衡常数大小关系为KⅠ___KⅡ(填“>”或“=”或“<”)。
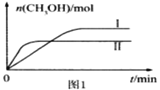
③一定温度下,往该容器中投入1 molCO2、3 mol H2 ,一段时间后达到平衡。若平衡后气体的压强为开始的0.8倍,则CO2的平衡转化率=____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com