
科目: 来源: 题型:
【题目】实验室需要0.3 mol·L-1硫酸溶液480 mL。根据这种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液需要的是____ (填序号),配制上述溶液还需用到的玻璃仪器是____(填仪器名称)。
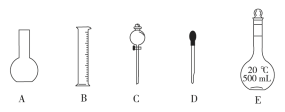
(2)下列操作中,是容量瓶所具备的功能有__________。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液 C.测量容量瓶规格以下的任意体积的液体 D.稀释某一浓度的溶液 E.量取一定体积的液体 F.用来加热溶解固体溶质
(3)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为__________mL(计算结果保留一位小数)。如果实验室有10 mL、15 mL、20 mL量筒,应选用__________mL的量筒最好。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是:_________。
(4)下列操作会使配制的硫酸溶液浓度偏低的是__________。
A.俯视刻度线定容 B.选用的容量瓶内有少量蒸馏水 C.定容摇匀后,液面下降,又加水至刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】金刚烷是一种重要的化工原料,工业上可通过下列途径制备:

请回答下列问题:
(1)环戊二烯分子中最多有__________个原子共面;
(2)金刚烷的分子式为____________________,其分子中的CH2基团有__________个;
(3)下面是以环戊烷为原料制备环戊二烯的合成路线:
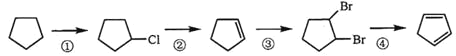
其中,反应①的产物名称是_____________,反应②的反应试剂和反应条件是_________,反应③的反应类型是_____________;
(4)已知烯烃能发生如下的反应:  ,请写出下列反应产物的结构简式:
,请写出下列反应产物的结构简式: ___________。
___________。
(5)A是二聚环戊二烯的同分异构体,能使溴的四氯化碳溶液褪色,A经高锰酸钾酸性溶液加热氧化可以得到对苯二甲酸[提示:苯环的烷基(—CH3,—CH2R,—CHR2)或烯基侧链经酸性高锰酸钾溶液氧化得羧基],写出A的一种结构简式(不考虑立体异构):________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关热化学方程式的叙述中,正确的是( )
A. 含20.0gNaOH的稀溶液与足量的稀硫酸完全中和,放出28.7kJ的热量,则表示中和热的热化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H=-114.8kJ·mol-1
B. 已知热化学方程式:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) △H=-98.32kJ·mol-1,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ
SO3(g) △H=-98.32kJ·mol-1,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ
C. 已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1,则H2的燃烧热为241.8kJ·mol-1
D. 已知石墨转化为金刚石为吸热,那么石墨比金刚石稳定
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)研究表明,某品牌打火机中的液体燃料为液态的烃甲,其分子中碳、氢原子个数比为2:5,此有机物的分子式为________________,该有机物同系物的通式为_____________,甲可能的结构简式为_____________、_______________;碳、氢个数比为1:2的烃乙可通过与![]() 加成得到甲,则乙为__________烃,写出乙可能的所有结构简式:____________________。
加成得到甲,则乙为__________烃,写出乙可能的所有结构简式:____________________。
(2)奥运火炬中使用的燃料为混合物,其主要成分为丙烷,请写出丙烷完全燃烧的化学方程式:____________。现将等质量的天然气和丙烷分别与足量氧气反应,则前者与后者消耗氧气的质量之比为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据所学知识,回答下列问题:
(1)在反应N2(g)+3H2(g) ![]() 2NH3(g)中,若以N2表示的该反应的化学反应速率为0.2 mol/(L·min),则以H2表示此反应的化学反应速率为 _____________ mol/(L·min)
2NH3(g)中,若以N2表示的该反应的化学反应速率为0.2 mol/(L·min),则以H2表示此反应的化学反应速率为 _____________ mol/(L·min)
(2)在5 L的恒容密闭容器中,充人0.1 mol N2和0.4 mol H2,在一定条件下发生反应,2s后测得N2的物质的量为0.09mol,则以NH3的浓度变化表示的反应速率为 ___________ mol/(L·s)
(3)将0.2 mol NH3充人容积为10 L的恒容密闭容器中,某温度下发生反应2NH3(g)![]() N2(g) + 3H2(g),在0~2s内,消耗NH3的平均速率为0.002 mol/(L·s),则在2s时,容器中生成_____________molH2,此时NH3的物质的量浓度为______________ mol/L。
N2(g) + 3H2(g),在0~2s内,消耗NH3的平均速率为0.002 mol/(L·s),则在2s时,容器中生成_____________molH2,此时NH3的物质的量浓度为______________ mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求完成下列填空:
(1)写出下列物质在水溶液中的电离方程式:①H2CO3:_______;②NaHCO3:___________。
(2)完成下列反应的离子方程式:①向NaHSO3溶液中加入过量NaHSO4溶液__;②小苏打溶液与乙酸溶液混合___;③FeBr2溶液中通入过量Cl2:____。
(3)25 ℃时,下列各组离子在指定溶液中一定能大量共存的是(______)
A.无色溶液中:Na+、NH4+、Cu2+、SO42-
B.0.1 mol·L-1的NH4HCO3溶液中:K+、SiO32-、AlO2-、Cl-
C.25 ℃时,Kw/c(H+)=1×10-2 mol·L-1的溶液中:K+、NO3-、S2-、ClO-
D.使甲基橙呈红色的溶液中:NH4+、Ba2+、Al3+、Cl-
(4)200 mL某溶液中有5种离子大量共存,其中4种离子的物质的量如下表:
离子 | H+ | K+ | NO3- | SO42- |
物质的量(mol) | 0.5 | 0.1 | 0.6 | 0.15 |
则另外一种离子是________(填写代号),该离子的浓度为________。
A.Fe2+ B.Cl- C.Al3+ D.ClO-
查看答案和解析>>
科目: 来源: 题型:
【题目】工业生产钠和烧碱的原理如下:①电解熔融氯化钠制钠:2NaCl(熔融) ![]() 2Na+Cl2↑,②电解饱和食盐水制烧碱:2NaCl+2H2O
2Na+Cl2↑,②电解饱和食盐水制烧碱:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑,下列有关说法正确的是( )
2NaOH+H2↑+Cl2↑,下列有关说法正确的是( )
A.在反应①和②中,氯化钠均既是氧化剂,又是还原剂
B.在反应①中氯气是还原产物,在反应②中氢气是还原产物
C.若标准状况下生成等体积的气体,则反应①和②中转移电子总数相等
D.若消耗等质量的氯化钠,则反应①和②中转移电子总数相等
查看答案和解析>>
科目: 来源: 题型:
【题目】由铜、铁和硫酸铜溶液组成的原电池中,作正极的是_______________(填化学式),正极的电极反应式为____________________________;作负极的是____________________(填化学式),电子由___________________(填“正”或“负”,下同)极经导线移向________________极,总反应的离子方程式为_________________________。若以反应![]() 来设计原电池,则电池的负极材料是____________________________(填化学式,下同),电解质溶液为________________________溶液。
来设计原电池,则电池的负极材料是____________________________(填化学式,下同),电解质溶液为________________________溶液。

查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目: 来源: 题型:
【题目】如图实验装置用于验证某些物质的性质。在试管A中装入足量的固体NaHCO3,D为固定蚊香的硬纸片。试回答下列问题:
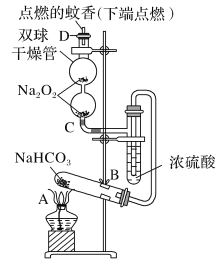
(1)在A试管内发生反应的化学方程式是_____。
(2)B装置的作用是_____。
(3)在双球干燥管内发生反应的化学方程式为____。
(4)双球干燥管内及D处观察到的实验现象是_____。
(5)若将干燥管内的Na2O2换成Na2O,则双球干燥管内及D处观察到的实验现象是:____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com