
科目: 来源: 题型:
| 符合的条件 | 物质的化学式或名称 | |
| (1) | 混合物 | 稀硫酸、空气 稀硫酸、空气 |
| (2) | 电解质,但熔融状态下并不导电 | HCl HCl |
| (3) | 电解质,但难溶于水 | CaCO3 CaCO3 |
| (4) | 非电解质 | NH3、CO2 NH3、CO2 |
| (5) | 既不是电解质,也不是 非电解质,但本身能导电 |
Cu、Hg、稀硫酸 Cu、Hg、稀硫酸 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
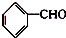
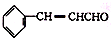 )在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的:
)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的: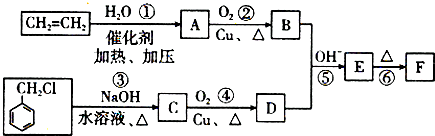
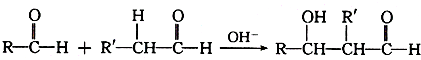

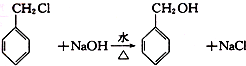

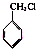 分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是
分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是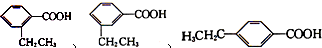 三种任写一种即可
三种任写一种即可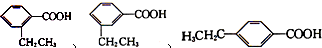 三种任写一种即可
三种任写一种即可查看答案和解析>>
科目: 来源: 题型:
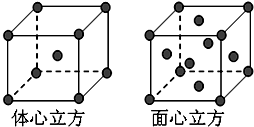 位于元素周期表前四周期的五种元素A、B、C、D、E,原子序数依次增大.A元素原子的最外层电子排布可表示为:asaap2a,B元素在地壳中含量居第二位,C与B位于同一周期,且是该周期元素中电负性最大的元素,D元素的+3价离子的3d亚层为半充满,E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子.
位于元素周期表前四周期的五种元素A、B、C、D、E,原子序数依次增大.A元素原子的最外层电子排布可表示为:asaap2a,B元素在地壳中含量居第二位,C与B位于同一周期,且是该周期元素中电负性最大的元素,D元素的+3价离子的3d亚层为半充满,E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子.查看答案和解析>>
科目: 来源: 题型:
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目: 来源: 题型:阅读理解
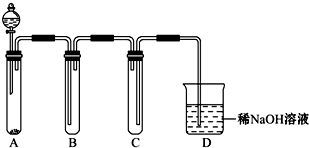 二氧化硫和氯气是中学化学中的常见气体,探究二者的制法和性质是十分重要的课题.
二氧化硫和氯气是中学化学中的常见气体,探究二者的制法和性质是十分重要的课题.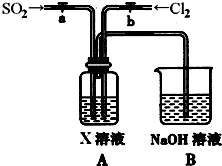
查看答案和解析>>
科目: 来源: 题型:
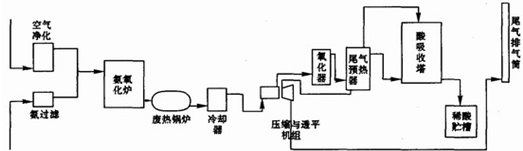
 氨气在化肥、致冷剂、有机合成工业中都有广泛应用.
氨气在化肥、致冷剂、有机合成工业中都有广泛应用.
| ||
| ||
| 催化剂 |
| 高温高压 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com