
科目: 来源: 题型:
【题目】普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为2Cu+Ag2O=Cu2O+2Ag。下列有关说法正确的是( )

A. 测量原理示意图中,电流方向从Cu流向Ag2O
B. 负极的电极反应式为2Cu+2OH--2e-=Cu2O+H2O
C. 电池工作时,OH-向正极移动
D. 2molCu与1molAg2O的总能量低于1molCu2O与2molAg具有的总能量
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题:
(除特别注明外,其它一律用化学式表示)

(1)由E形成的物质中硬度最大的是___(填名称),属于___(填“晶体类型”)。
(2)最高价氧化物水化物中碱性最强的化合物的电子式是___,该碱溶液与D的最高价氧化物反应的离子方程式___。
(3)常用作光导纤维的是___。
(4)G、H、I形成的气态氢化物稳定性由强到弱的顺序___。
(5)H、J、K的最高价氧化物对应水化物的酸性由强到弱的顺序___。
(6)I、J、K三种元素形成的离子,离子半径由大到小的顺序是___。
(7)元素I的氢化物的结构式为___;该氢化物常温下和元素K的单质反应的化学方程式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某硫原子的质量是ag,12C原子的质量是bg,若NA只表示阿伏加德罗常数的数值,则下列说法中正确的是( )
①该硫原子的相对原子质量为![]() ②mg该硫原子的物质的量为
②mg该硫原子的物质的量为![]() mol
mol
③该硫原子的摩尔质量是aNA g ④ag该硫原子所含的电子数为16NA
A. ①③ B. ②④ C. ①② D. ②③
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法正确的是
A. 已知HI(g) ![]() 1/2H2(g)+1/2I2(s) ΔH=-26.5 kJ·mol-1,由此可知1 mol HI气体在密闭容器中充分分解后可以放出26.5 kJ的热量
1/2H2(g)+1/2I2(s) ΔH=-26.5 kJ·mol-1,由此可知1 mol HI气体在密闭容器中充分分解后可以放出26.5 kJ的热量
B. 已知2H2(g)+O2(g)===2H2O(g) ΔH=-571.6 kJ·mol-1,则氢气的燃烧热为ΔH=-285.8 kJ·mol-1
C. 已知2C(s)+2O2(g)=2CO2(g) ΔH1, 2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1<ΔH2
D. 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)===CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、D、E、G是原子序数依次增大的五种短周期元素,A与E同主族,A、B和E的原子最外层电子数之和为19,B与G的单质都能与H2反应生成“HX”(X代表B或G)型氢化物,D为同周期主族元素中原子半径最大的元素。
(1)B在元素周期表中的位置是______。
(2)D的两种常见氧化物中均含有____________(填“离子键”或“共价键”)。
(3)E的最高价氧化物对应水化物的浓溶液和木炭共热,反应的化学方程式为____________。
(4)D的最高价氧化物对应水化物的溶液与G的单质反应,反应的离子方程式为___________。
(5)用原子结构解释“B、G单质都能与H2反应生成HX型氢化物”的原因:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】NaNO2是一种食品添加剂,它能致癌。酸性 KMnO4溶液与 NaNO2。的反应方程式是MnO4-+NO2-+□→Mn2++NO3-+H2O。下列叙述中正确的是( )
A. 该反应中 NO2-被还原 B. 反应过程中溶液的pH 减小
C. 生成1 mol NaNO3需消耗 0.4mol KMnO4 D. □中的粒子是 OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】在20℃,5.05×105Pa条件下,密闭容器中进行反应2A(g)+xB(g)![]() 4C(g),达平衡时c(A)=1.00molL-1,现将压强减小到1.01×105Pa,建立平衡后,c(A)=0.18molL-1,则下列说法正确的是 ( )
4C(g),达平衡时c(A)=1.00molL-1,现将压强减小到1.01×105Pa,建立平衡后,c(A)=0.18molL-1,则下列说法正确的是 ( )
A.系数x >2
B.若增大该体系的压强,平衡向左移动,化学平衡常数变小
C.若增大该体系的压强,平衡向右移动,化学平衡常数不变
D.该反应的化学平衡常数表达式是K=![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】利用来源丰富、含碳原子数较少的烃为原料合成性能优良的高分子材料具有现实意义。以甲烷和烃C合成两种高分子材料B与F(F为聚酯类高分子化合物)的路线如图:
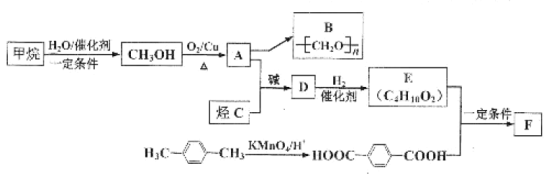
已知:①H-C![]() C-H+2
C-H+2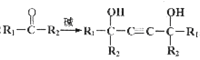 ;
;
②烃C的质谱图如图所示:
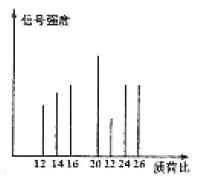
请回答下列问题:
(1)有机物A→B的反应类型是__(填“加聚”或“缩聚”)反应;烃C的结构简式为___。
(2)![]() 的化学名称为___,与其互为同分异构的芳香烃还有___种。
的化学名称为___,与其互为同分异构的芳香烃还有___种。
(3)有机物D中所含官能团名称为____
(4)写出D转化为E的化学方程式_____
(5)F的结构简式为__,若F的平均相对分子质量为10000,则其平均聚合度约为___(填字母标号)。
a.45 b.56 c.66 d.69
(6)参照以上合成路线,以烃C和溴乙烷为有机原料(无机试剂任选),设计制备有机化合物H3C-CH(OH)-C≡C-CH(OH)-CH3的合成路线:___
查看答案和解析>>
科目: 来源: 题型:
【题目】向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s) ![]() bZ(g) △H<0。图是容器中X、Z的物质的量浓度随时间变化的曲线。根据以上信息,下列说法正确的是
bZ(g) △H<0。图是容器中X、Z的物质的量浓度随时间变化的曲线。根据以上信息,下列说法正确的是
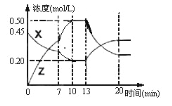
A. 根据上图可求得方程式中a∶b=1:3
B. 推测在第7min时曲线变化的原因可能是升温
C. 推测在第13min时曲线变化的原因可能是降温
D. 用X表示0~10min内该反应的平均速率为v(X)=0.045mol/(L·min)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,用排水法收集气体 | HX放出的氢气多且产生等量H2反应速率快 | 酸的强弱:HX<HY |
B | 向2 mL 0.1 mol/L Na2S溶液中滴2滴0.1 mol/L ZnSO4溶液;再滴2滴0.1 mol/L CuSO4 | 先生成白色沉淀,后生成黑色沉淀 | 溶度积(Ksp):ZnS>CuS |
C | 向FeCl3和KSCN混合溶液中,加入少量KCl的固体 | 溶液颜色变浅 | FeCl3+3KSCN |
D | 常温下,用pH计分别测定饱和NaA溶液和饱和NaB溶液的pH | pH:NaA>NaB | 常温下酸性:HA﹤HB |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com