
科目: 来源: 题型:
【题目】有A、B、C、D 四种短周期元素,A 与B 可形成离子化合物BA,BA 中阴阳离子的核外电子排布相同;B 原子最外层只有-个电子;C 元素有三种不同的核素C1、C2、C3,且三种核素的质量数之比为1:2:3;D 原子的质子数是A、B、C 三种原子质子数之和的![]() 。
。
回答下列问题:
(1)写出各元素的元素符号:A____,B____,C____,D____。
(2)写出C1、C2、C3三种核素的原子符号:C1____,C2_____,C3______。
(3)C、D 两种元素形成的微粒X 与化合物BA 中的阳离子所含的质子数和电子数分别相等,则X 的化学式是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(一)常温下将0.01 molCH3COONa和0.005molHCl 溶于水,配成0.5 L混合溶液。
(1)溶液中共有________种微粒。
(2)溶液中有两种微粒的物质的量之和一定等于0.01 mol ,它们是____________。
(3)溶液中n ( CH3COO- ) + n ( OH- ) - n( H+ ) =_________mol。
(二)常温下,取浓度相等的NaOH和HCl溶液,以3∶2体积比相混和,所得溶液的pH等于12,则原溶液的浓度为_________________ mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】向100mL0.1mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中逐滴滴入0.1mol·L-1Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示。则下列说法中正确的是

A. a点时溶液中所含主要溶质为(NH4)2SO4
B. a→b段发生反应的离子方程式是 SO![]() +Ba2+===BaSO4↓
+Ba2+===BaSO4↓
C. b点为最大沉淀量,对应的纵坐标值为0.02
D. c点加入Ba(OH)2溶液的体积为200 mL
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
阳离子 | Na+、K+、Cu2+ |
阴离子 | SO42-、OH- |
如图1所示装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如图2所示。请回答下列问题:
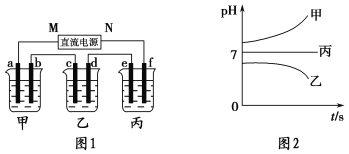
(1)M为直流电源的________极,b电极上发生的电极反应为______________________。
(2)计算e电极上生成的气体在标准状况下的体积为________________。
(3)写出乙烧杯中的总反应方程式:____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用图表来处理数据是发现科学规律的一种重要方法。
(1)下图是原子序数为1~18的元素原子的最外层电子数随原子序数变化的直方图。图中元素a 是__,b 是____。

(2)下图表示元素的一种性质随原子序数变化的情况,根据分析,该图纵坐标表示的是_________。

(3)下表给出了部分元素的原子半径。
元素符号 | Li | Be | B | C | N | O | F | Na | K | Rb | Cs |
原子半径/nm | 0.152 | 0.089 | 0.082 | 0.077 | 0.075 | 0.074 | 0.071 | 0.186 | 0.227 | 0.248 | 0.265 |
请根据表中数据分析同周期元素原子半径的递变规律是______,同主族元素原子半径的递变规律是_____根据表中得出的规律比较Ca2+和Cl-的半径大小:r(Ca2+)_____r(Cl-)(填“>”“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上利用H2合成氢的反应原理为:3H2(g)+N2(g) ![]() 2NH3(g)。现有甲、乙两个容积为1L的密闭容器.在相同条件下,按不同的反应物投入量进行合成氢反应相关数据如下表示:
2NH3(g)。现有甲、乙两个容积为1L的密闭容器.在相同条件下,按不同的反应物投入量进行合成氢反应相关数据如下表示:
容器 | 甲 | 乙 |
反应物投入量 | 2molH2、2molN2 | 4malH2.4molN2 |
平衡时N2的浓度(mol/L) | c1=1.5 | c2 |
NH3的体积分数 | ω1 | ω2 |
混合气体的密度(g/L) | ρ1 | ρ2 |
(1)下列情况下,反应达到平衡状态的是_____(填序号)
A、3molH-H共价键断裂同时有6molN-H共价键形成
B、3v正(N2)=v逆(H2)
C、混合气体的平均相对分子质量保持不变
(2)反应的平衡常数K=_____________________(结果保留3位有效数字).
(3)分析上表中的数据,有以下关系:c2________3mol/L;ω1________ω2(填“>”、“<”、“=”);
查看答案和解析>>
科目: 来源: 题型:
【题目】某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度与加入铁粉的物质的量之间的关系如图所示。则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )
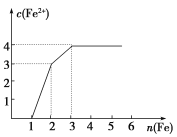
A. 1∶1∶1 B. 1∶3∶1
C. 3∶3∶8 D. 1∶1∶4
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为___________(写离子符号);若所得溶液c(HCO3)∶c(CO32)=2∶1,溶液pH=___________。(室温下,H2CO3的K1=4×107;K2=5×1011)
(2)CO2与CH4经催化重整,制得合成气:CH4(g)+ CO2(g) ![]() 2CO (g)+ 2H2(g)
2CO (g)+ 2H2(g)
已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=______。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是____(填“A” 或“B ”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下:

己知:Zn及其化合物的性质与Al及其化合物的性质相似。下列相关说法错误的是( )
A. 用NaOH溶液处理废旧镀锌铁皮的作用是去除油污、溶解镀锌层
B. 调节溶液A的pH产生Zn(OH)2沉淀,经抽滤、洗涤、灼烧即可制得ZnO
C. 由溶液B制得Fe3O4胶体粒子的过程中,须持续通N2,其原因是防止Fe2+被氧化
D. Fe3O4胶体粒子能用减压过滤法实现固液分离
查看答案和解析>>
科目: 来源: 题型:
【题目】(一)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
(1)写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式_______________。
(2)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:_______________________。
(3)欲用2LNa2CO3溶液将4.66 g BaSO4(233 g/moL)固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为__________________。[已知:常温下Ksp(BaSO4)=1×10-11,Ksp (BaCO3)=1×10-10]。(忽略溶液体积的变化)
(二)向20 mL硫酸和盐酸的混合溶液中,逐滴加入0.05 mol·L-1Ba(OH)2溶液时,生成沉淀的质量变化及由此而引起的溶液的pH的变化如图所示。
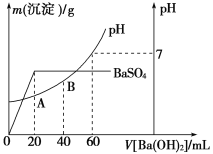
计算:(1)原混合溶液中c(Cl-)=________。
(2)A点的pH=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com