
科目: 来源: 题型:
【题目】金属钠是在1807年通过电解氢氧化钠制得的,这个原理应用于工业生产,约在1891年才获得成功。1921年实现了电解氯化钠制钠的工业方法,其反应原理是:2NaCl(熔融)![]() 2Na+Cl2↑。回答下列有关单质钠的问题:
2Na+Cl2↑。回答下列有关单质钠的问题:
(1)下列各项中属于保存金属钠的正确方法是____。
A.放在棕色瓶中 B.放在细沙中
C.放在水中 D.放在煤油中
(2)钠长时间放在空气中,最后的产物主要成分是____。
A.Na2O B.Na2O2 C.NaOH D.Na2CO3
(3)将一小块钠放在水平放置的试管中部,用酒精灯加热充分反应(如图Ⅰ所示),请写出该反应的化学方程式____________,生成物的颜色为____。将该试管冷却后直立,滴加几滴水(如图Ⅱ所示),发生反应的化学方程式为____________,检验该反应产生的气体的方法是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生产生活密切相关,下列有关说法不正确的是
A. 富脂食品包装中常放入活性铁粉袋,以防止油脂氧化变质
B. 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造晶体管
C. Ni-Zn化合物的纳米颗粒可作![]() 反应的催化剂,提高苯的转化率
反应的催化剂,提高苯的转化率
D. 用K2FeO4代替Cl2处理饮用水时,既有杀菌消毒作用,又有净水作用
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化还原反应原理在生产生活和科学研究中应用广泛。
(1)下列表述中没有氧化还原反应发生的是________。
a.滴水成冰 b.蜡炬成灰 c.百炼成钢
(2)NH3和Cl2反应的方程式为: NH3+ Cl2—N2+ HCl
①该反应中被氧化的元素是________(填元素名称),氧化剂是______(填化学式)。
②配平该方程式:NH3 + Cl2 — N2 + HCl __
③工业生产中常用喷洒氨水的方法来检查是否有Cl2泄漏,若Cl2有泄漏,可以观察到的现象是________,产生该现象的反应方程式为________。
(3)“地康法”制氯气的反应原理图示如下:

①反应I的化学方程式为________。
②反应II属于________反应。(填四种基本反应类型之一)。
③若要制得标准状况下氯气11.2L,则整个反应中转移电子的物质的量为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学实验装置的科学设计是实验是否取得预期效果的关键。请回答下列有关实验装置的相关问题:
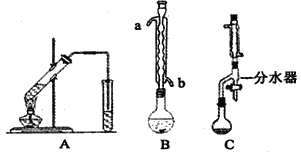
I.图A为教材制备乙酸乙酯的实验装置,甲同学认为图B装置比A要好,则冷却水应从_______口进入;乙同学认为图C装置效果更好,理由是________________。
Ⅱ.“摩尔盐”[(NH4)2Fe(SO4)2·6H2O]是分析化学中的重要试剂。已知:摩尔盐隔绝空气加热至500℃时可完全分解。某学习小组欲探究其分解产物。
(1)(提出猜想)小组同学认为分解产物可能有以下几种情况:
A.Fe2O3SO2NH3H2O B.FeO SO3NH3H2O
C.FeO SO2NH3H2O D.Fe2O3SO3SO2NH3H2O
根据所学知识,可确定______________不成立(填序号)
(2)(药品验纯)甲同学提出可以用湿润的红色石蕊试纸、稀盐酸和__________溶液检验出“摩尔盐”中的三种离子;取一定量的“摩尔盐”配成溶液,取少量溶液置于试管中,向其中滴加______________(填试剂名称和实验现象),则“摩尔盐”未因氧化而变质。
(3)(实验探究)为检验分解产物,甲同学设计了如下实验装置。

①取一定量“摩尔盐”置于加热管A中,加热至分解完全后打开K,再通入N2,目的是__________。
②实验中观察到A中固体逐渐变为红棕色,B、C中均产生白色沉淀。C中发生反应的离子方程式为_____。
③实验验证取A中残留物少许加入稀硫酸溶解,再滴入KMnO4稀溶液,不褪色证明产物不含_______。
(4)(实验结论与反思)通过实验现象和认真反思,上述猜想中一定正确的是_________(填序号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】本题为选做题,包括A、B两题。选学《化学与生活》模块的考生答A题,选学《有机化学基础》模块的考生答B题,每位考生只可选做1题。若两题都作答,则以A题计分。
A. 《化学与生活》

(1) 营养均衡是保证健康的重要方面。某种食品的配料标签如图所示,根据该食品的配料填空。
①该食品配料中,富含糖类的物质是____。
②该食品配料中,苯甲酸钠的作用是____。
③该食品配料中,碳酸氢钠的作用是____。
(2) 材料是社会经济发展的物质基础。
①钢铁在生活中的应用十分广泛,在潮湿的空气中容易发生____腐蚀。
②普通玻璃的主要成分是Na2SiO3、CaSiO3和 ____(填化学式)。____(填化学式)对玻璃有腐蚀作用,可用于在玻璃仪器上标注刻度及文字。
③聚氯乙烯塑料的结构简式为________,玻璃钢属于________(填“无机非金属材料”“功能高分子材料”或“复合材料”)。
(3)化学与技术的发展是解决环境问题的有效路径。
①减少燃煤产生气体SO2的排放,能够有效控制______(填“硝酸型酸雨”“硫酸型酸雨”或“光化学烟雾”)的形成;向燃煤中加入适量的____(填名称)可减少燃煤烟气中的SO2排放。
②燃煤产生的CO2用氨水吸收可得到氮肥碳铵(NH4HCO3),写出该反应的化学方程式______________。工业上通常采用沉淀法除去废水中的重金属离子,需要控制废水的_____使重金属离子以氢氧化物的形式沉淀出来。
③工业上采用将CO在500 ℃、铝矾催化作用下还原SO2,反应得到两种产物,其中一种产物在常温下是固体。该项技术可大大降低燃煤烟气中SO2的含量,反应的化学方程式为____________________。
B.《有机化学基础》
(1) 有机物的结构决定了其所具有的性质。
①下列有机物不溶于水的是____(填字母)。
a. 乙醛 b. 乙醇 c. 乙酸乙酯
②下列化合物中,不能与新制氢氧化铜悬浊液反应的是____(填字母)。
a. 福尔马林 b. 乙烯 c. 乙酸
③下列试剂中,可用于鉴别苯和甲苯的是____(填字母)。
a. 水 b. 溴水 c. 酸性KMnO4溶液
(2)水杨酸是一种柳树皮提取物,是天然的消炎药,其结构为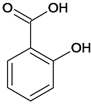 。
。
①水杨酸苯环上的一氯代物有____种。
②水杨酸需密闭保存,其原因是__________。
③水杨酸与足量NaHCO3溶液反应,所得有机产物的结构简式为______。
(3)化合物C是一种医药中间体,由甲苯制备化合物C的路线如下:
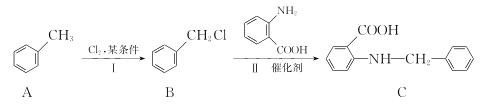
①A→B的反应类型是____。
②B分子中化学环境不同的氢原子有____种。
③D是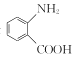 的一种同分异构体,D分子中只有一种官能团,苯环上的一氯代物有2种。则D的结构简式为________。
的一种同分异构体,D分子中只有一种官能团,苯环上的一氯代物有2种。则D的结构简式为________。
④B→C的反应中能生成化合物E,E和C的相对分子质量相同,写出生成化合物E的化学方程式_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】胆矾(CuSO4·5H2O)是铜的重要化合物,在工业生产中应用广泛。实验室制备胆矾的流程如下:

(1) 稀硫酸、稀硝酸与铜粉反应生成一种无色气体,该气体是_____(写化学式),制得的胆矾晶体中可能存在的杂质是_____(写名称)。
(2) 实验室可采用沉淀法测定所得胆矾晶体中CuSO4·5H2O的含量,步骤如下:
①取样、称量;②加水充分溶解;③加入BaCl2溶液;④过滤、洗涤、干燥;⑤称量、计算。在过滤前,需要检验SO42-是否沉淀完全,检验方法是____________________________________________
(3) 若改变反应条件可获得化学式为Cux(OH)y(SO4)z·nH2O的晶体,用热重分析仪对Cux(OH)y(SO4)z·nH2O晶体进行分析并推断该晶体的化学式。取3.30 g晶体样品进行热重分析,所得固体质量的变化曲线如下图所示。已知:体系温度在650 ℃及以下时,放出的气体只有水蒸气;实验测得温度在650 ℃时,残留固体的组成可视为aCuO·bCuSO4;温度在1 000 ℃以上时,得到的固体为Cu2O。
请回答下列问题:
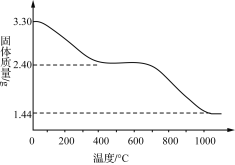
①温度650~1 000 ℃产生的气体中,n(O)∶n(S)____(填“>”“<”或“=”)3。
②通过计算推断Cux(OH)y(SO4)z·nH2O晶体的化学式:__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学实验中若使某步中的有害产物作为另一步的反应物,形成一个循环,则可不再向环境排放该种有害物质。在如图所示有编号的反应中,属于氧化还原反应的有

A. 3个 B. 4个 C. 5个 D. 6个
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组测定某Fe2(SO4)3样品(只含少量FeCl2杂质)中铁元素的质量分数,按以下实验步骤进行操作:
①称取ag样品,置于烧杯中;
②加入50 mL 1.0 mol/L稀硫酸和一定量的蒸馏水,使样品溶解,然后准确配制成250.0 mL溶液;
③量取25.0 mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦……

请根据上面叙述,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器有E和________(填字母)。
(2)步骤②中:配制50 mL,1.0 mol/L稀H2SO4需要98%(密度1.84 g/cm3)的浓H2SO4体积为________ mL,量取该体积的浓H2SO4用到量筒规格是________。
(3)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式![]() Fe2++
Fe2++![]() ClO2+
ClO2+![]()
![]() ===
===![]() Fe3++
Fe3++![]() Cl-+
Cl-+![]() H2O__________________,从理论上分析,上述实验中若将氯水改为ClO2时,对实验结果的影响是__________(填“偏大”“偏小”或“不影响”),等物质的量ClO2与Cl2的氧化效率之比为__________。
H2O__________________,从理论上分析,上述实验中若将氯水改为ClO2时,对实验结果的影响是__________(填“偏大”“偏小”或“不影响”),等物质的量ClO2与Cl2的氧化效率之比为__________。
(4)第⑥步的操作中,将沉淀物转移到________(填仪器名称)中加热,冷却到室温,称量其质量为m1g,再次加热并冷却至室温称量其质量为m2g,若m1与m2差值较大,接下来的操作应当是________________。
(5)若步骤⑥不在干燥器中冷却,则测定的铁元素的质量分数会________(填“偏大”“偏小”或“不影响”);若容器质量是W1g,最终容器和固体的总质量是W2g,则样品中铁元素的质量分数为________(列出算式,不需化简)。
查看答案和解析>>
科目: 来源: 题型:
【题目】离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知Ca2+、OH-、HCO3—的摩尔电导率分别为0.60、1.98、0.45,据此可判断,向饱和的澄清石灰水中通入过量的二氧化碳,溶液导电能力随二氧化碳通入量的变化趋势正确的是( )
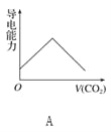
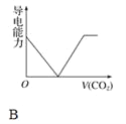

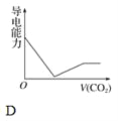
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com