
科目: 来源: 题型:
【题目】测定有机化合物中碳和氢的组成常用燃烧分析法,下图是德国化学家李比希测定有机物组成的装置,氧化铜作催化剂,在750℃左右使有机物在氧气流中全部氧化为CO2和H2O,用含有固体氢氧化钠和氯化钙的吸收管分别吸收CO2和H2O。

试回答下列问题:
(1)甲装置中盛放的是________,甲、乙中的吸收剂能否颠倒?________。
(2)实验开始时,要先通入氧气一会儿,然后再加热,为什么? _____________________。
(3)将4.6 g有机物A进行实验,测得生成5.4 g H2O和8.8 g CO2,则该物质中各元素的原子个数比是________。
(4)经测定,有机物A的核磁共振氢谱图显示有三组峰,则A的结构简式为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:①Fe+H2SO4(稀)=FeSO4+H2↑
②Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
③KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
试回答下列问题:
(1)当反应①转移3mol电子时,消耗H2SO4的质量是___g,产生氢气的体积(标准状况)_____L。
(2)反应②中_______作氧化剂,________是氧化产物。
(3)当反应②中生成11.2LSO2气体(标准状况下)时,被还原的H2SO4的物质的量是____。
(4)用双线桥法表示反应②电子转移的方向和数目(在化学方程式上标出)_______。
(5)反应③中氧化产物与还原产物的物质的量之比为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在标准状况下有一定量的气体如下:①6.72LCH4、②3.01×1023个HCl分子、③13.6gH2S、④0.2molNH3,下列对这四种气体的关系从大到小排列的组合中正确的是( )
a.体积:②>③>①>④ b.密度:②>③>④>①
c.质量:②>③>①>④ d.氢原子个数:①>③>④>②
A.abcB.bcdC.abcD.abcd
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用密度为1.19 g/mL、质量分数为36.5%的浓盐酸配制500 mL 0.4 mol/L盐酸。回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为______。
(2)欲用上述浓盐酸和蒸馏水配制500 mL 0.4 mol/L盐酸。
①需量取______mL上述浓盐酸进行配制。
②该配制实验中所需要的主要玻璃仪器有量筒、烧杯、玻璃棒、_____________。
③用上述浓盐酸配制0.4 mol/L盐酸,定容的操作是_____________________。
(3)配制500 mL 0.4 mol/L盐酸时,下列操作中会导致结果偏低的是____________(填序号)。
a.用量筒量取浓盐酸时仰视量筒的刻度
b.用量筒量取浓盐酸后洗涤量筒,并把洗涤液转入容量瓶中
c.摇匀后发现液面低于刻度线,又加水至刻度线
d.将所配制溶液从容量瓶转移到试剂瓶中时,有少量液体溅出
查看答案和解析>>
科目: 来源: 题型:
【题目】一般较强酸可制取较弱酸,这是复分解反应的规律之一。已知20℃时:K(C6H5OH)=1.2×10-10、K(CH3COOH)=1.8×10-5、K(H2CO3)=4.3×10-7、K(HCO3-)=5.6×10-11、K(HCN)=4.9×10-10。
(1)请根据上述信息求Na2CO3+C6H5OH![]() NaHCO3+C6H5ONa的化学平衡常数K=__________;
NaHCO3+C6H5ONa的化学平衡常数K=__________;
(2)常温下某电解质溶解在水中后,溶液中的c(H+)=10-9molL-1,则该电解质可能是_________(填序号);
A.CuSO4 B.HCl C.Na2S D.NaOH E.K2SO4
(3)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性。①浓度为1.0×l0-3mol·L-1的氨水b L;②c(OH-)=1.0×10-3mol·L-1的氨水c L;③c(OH-)=1.0×10-3molL-1的氢氧化钡溶液d L。则a、b、c、d之间由大到小的关系是_________;
(4)室温时,向0.2molL-1的醋酸溶液中加入等体积的0.1molL-1的NaOH(aq),充分反应后所得溶液的pH=4,则所得溶液中各离子浓度大小关系是________________,所得溶液中的物料守恒式为:________+________=__________=_________ molL-1,所得溶液中c(CH3COOH)=____________________molL-1(写出算式,不做计算);
(5)已知常温时Ksp(AgCl)=1.8×10-10mol2L-2,向50mL 0.018molL-1的AgNO3溶液中加入相同体积0.020molL-1的盐酸,则c(Ag+)=_______________,此时所得混合溶液的pH=_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】 (1)一块表面已被氧化为Na2O的钠块10.8 g,将其投入100 mL水中,产生标准状况下2.24 L气体(假设溶液体积变化可忽略)。则这块钠块中所含单质钠的质量分数是_________(保留小数点后一位)。所得溶液中溶质的物质的量浓度为_________。
(2)已知实验室也可用KMnO4和浓盐酸反应制备氯气,化学方程式为2KMnO4+16HCl=2KCl+5Cl2↑+2MnCl2+8H2O,请用双线桥法表示出电子转移的方向和数目______________。该反应中还原产物为______________。
(3)碳酸氢钠俗称小苏打,请写出碳酸氢钠的电离方程式_______________________。碳酸氢钠既能与酸反应又能与碱反应,请写出碳酸氢钠溶液与NaOH溶液反应的离子方程式
_______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4(s)2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是
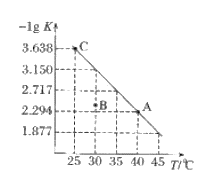
A. 该反应的△H>0
B. C点对应状态的平衡常数K(C)=103.638
C. NH3的体积分数不变时,该反应一定达到平衡状态
D. 30℃时,B点对应状态的![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学设计了利用氯酸钾分解制O2测定气体摩尔体积的探究实验。实验步骤如下:

①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95 g。
②连接好实验装置,
③加热,开始反应,直到不再有气体产生为止
④测量排入量筒中水的体积为279.7 mL
⑤准确称量试管和残留物的质量为15.55 g
根据上述实验过程,回答下列问题:
(1)请补充②中的实验步骤___________________。
(2)以下是测量收集到气体体积必须包括的几个步骤:
a.调整量筒的高度使广口瓶和量筒内的液面高度相同;b.使试管和广口瓶内气体都冷却至室温;c.读取量筒内液体的体积。这三步操作的正确顺序是________(请填写步骤序号)。进行实验操作c时,若仰视读数,则读取氧气的体积______(填“偏大”、“偏小”或“无影响”)。
(3)实验过程中产生氧气的物质的量是__________mol;实验测得该条件下的气体摩尔体积是____(保留小数点后两位)。
(4)若欲检验试管中产物所含的阴离子,方案为:将固体冷却后溶于水,过滤,_________________________________(填写具体实验方案)。若想检验产物中所含的阳离子方法为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】无水FeCl3呈棕红色,固体FeCl3极易潮解,100℃左右时升华。某学习小组利用如图装置(某些夹持仪器略去)制备并收集无水FeCl3固体。请回答:

(1)按气流方向各装置依次连接的合理顺序为__________________(填仪器接口的字母,部分装置可重复使用)。
(2)连接好各装置进行实验,实验步骤如下:检查装置气密性后,装入药品,________(请按正确的顺序填入下列步骤的序号)。
①加热Fe粉反应一段时间②打开分液漏斗活塞通一段时间气体
③关闭分液漏斗活塞 ④停止加热,充分冷却
(3)装置F的作用为_____________________,装置E中冷水浴的作用为__________。
(4)写出装置B中所发生反应的化学方程式______________________________。
(5)写出装置D中所发生反应的离子方程式______________________________。
(6)若将装置B中产生的气体通入水中,则发生反应的离子方程式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将V L HCl气体(标准状况),溶解在1 L水(水的密度为1 g/cm3)中,形成饱和溶液,所得溶液的密度为ρ g/mL,质量分数为ω,物质的量浓度为c mol/L,溶解度为s g,下列关系式不正确的是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com