
科目: 来源: 题型:
【题目】现有七种元素,其中A,B,C,D,E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
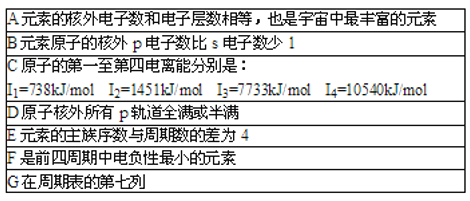
(1)已知BA5为离子化合物,写出其电子式__;
(2)B基态原子中能量最高的电子,其电子云在空间有_个方向,原子轨道呈_____形;
(3)某同学根据上述信息,推断C基态原子的核外电子排布为![]() 该同学所画的电子排布图违背了__;
该同学所画的电子排布图违背了__;
(4)G位于__族_区,价电子排布式为__;
(5)DE3中心原子的杂化方式为__,用价层电子对互斥理论推测其空间构型为__.
查看答案和解析>>
科目: 来源: 题型:
【题目】已知下列反应的热化学方程式为
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+![]() O2(g)=H2O(l) ΔH3=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH3=-285.8 kJ·mol-1
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的ΔH为( )
A. -488.3 kJ·mol-1 B. -191 kJ·mol-1
C. -476.8 kJ·mol-1 D. -1 549.6 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中不属于氧化还原反应的是
A.NaOH+HCl=NaCl+H2OB.3Fe+2O2![]() Fe3O4
Fe3O4
C.Fe2O3 +3CO![]() 2Fe+3CO2D.2H2O
2Fe+3CO2D.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
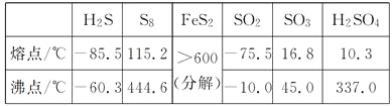
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为____________________________,基态S原子电子占据最高能级的电子云轮廓图为________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是__。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________________。
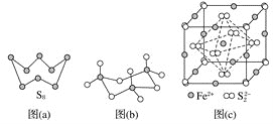
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为________形,其中共价键的类型有________种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为anm、FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为______________________________g·cm-3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为________nm。
所形成的正八面体的体心,该正八面体的边长为________nm。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.从铁、盐酸、氧气、水、硝酸银溶液五种物质中选出一种或两种作为反应物,按下列反应类型各写一个化学方程式:
(1)化合反应___。
(2)置换反应___。
Ⅱ.按下列要求各写出一个化学反应的化学方程式(反应物自选):
(1)有水生成的化合反应___。
(2)由硝酸银生成硝酸铜的置换反应__。
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2和O3组成的混合气体的质量为14.0g,其中碳原子与氧原子的物质的量之比是1:8。计算:
①该混合气体中CO2 的物质的量是______?
②标准状况下,该混合气体的体积是______?
③该混合气体的平均摩尔质量是______?
查看答案和解析>>
科目: 来源: 题型:
【题目】K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]![]() 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。
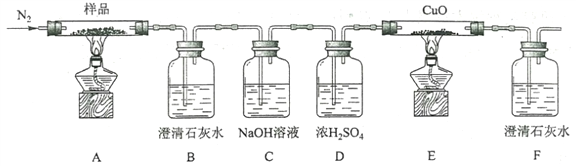
①通入氮气的目的是________________________________________。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有___________、___________。
③为防止倒吸,停止实验时应进行的操作是_____________________________。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:________________。
(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是___________________________。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为实验室蒸馏自来水得到少量蒸馏水的装置示意图,请根据图示回答下列问题:
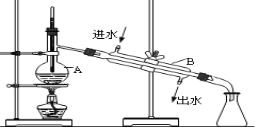
(1)装置中仪器A、B的名称是_____________________ 、 ______________________。
(2)请指出上图中的两处明显错误:____________________、_____________________。
(3)实验时A中除加入少量自来水外,还需加入少量的沸石,其作用是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 同一原子中,2p、3p、4p能级的轨道数依次增多
B. 电子排布式(22Ti)1s22s22p63s23p10违反了能量最低原则
C. ![]() 表示的原子能量处于最低状态
表示的原子能量处于最低状态
D. 正三价阳离子的电子排布式为1s22s22p63s23p63d5的元素在周期表中位于Ⅷ族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com