
科目: 来源: 题型:
【题目】利用苯甲醛(C6H5CHO)在NaOH溶液中可以制苯甲醇(C6H5CH2OH)和苯甲酸(C6H5COOH)。实验流程如图:
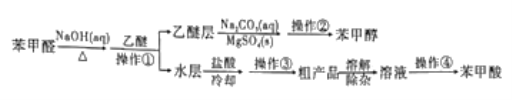
相关物质的性质如下表所示。回答下列问题:
物质 | 对水的相对密度 | 沸点 | 溶解性 |
苯甲醇 | 1.04 | 205.7 | 微溶于水,易溶于乙醚 |
苯甲酸 | 1.27 | 249 | 微溶于冷水,可溶于热水,易溶于乙醚 |
乙醚 | 0.71 | 34.6 | 与水互不相溶 |
(1)操作①中,需要用到的玻璃仪器除烧杯外,还有____。操作①后,苯甲醇在容器中混合物的_____(填“上”或“下”)层。
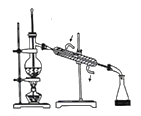
(2)乙醚层用10%Na2CO3溶液洗涤的目的是_____。操作②前常需要加入MgSO4,作用是______。操作②的装置如图,指出该装置图中两个错误:______。
(3)操作③是______,操作④是______。
(4)取106.00g苯甲醛反应,若苯甲醛的转化率为80%,乙醚的萃取率为100%,洗涤等过程损失率为10%,则最终可制得苯甲醇___g(结果保留小数点后两位)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是利用阴离子交换膜和过滤膜制备高纯度的Cu的装置示意图,下列有关叙述不正确的是
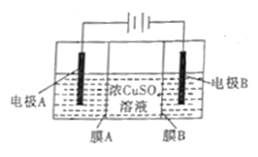
A. 电极A是粗铜,电极B是纯铜
B. 电路中通过1mol电子,生成32g铜
C. 溶液中SO42-向电极A迁移
D. 膜B是过滤膜,阻止阳极泥及杂质进入阴极区
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求回答下列问题:
(1)甲醇是一种重要的化工原料,有着重要的用途和应用前景。工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g)CH3OH(g);△H1
反应II:CO2(g)+3H2(g)CH3OH(g)+H2O(g);△H2
①上述反应中原子利用率百分之百的是______(填“I”或“Ⅱ”)
②下表所列数据是反应I在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断△H1______0,T℃时,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,此时T为______。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______。
查看答案和解析>>
科目: 来源: 题型:
【题目】标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g/mL),所得溶液的密度为ρ g/mL,质量分数为w,物质的量浓度为c mol/L,则下列关系中不正确的是
A.c=1 000Vρ/(17V+22 400)B.w=17c/(1000ρ)
C.w=17V/(17V+22 400)D.ρ=(17V+22 400)/(22.4+22.4V)
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学实验小组用0.2000mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O42H2O,杂质不与KMnO4反应).实验步骤如下:
(1)称取13.0g草酸晶体,配成250.00mL水溶液.此操作过程必须用到的2种定量仪器是 ______ 和 ______ .
(2)量取草酸溶液25.00mL放入锥形瓶中,用0.2000mol/L的酸性KMnO4溶液滴定.
①量取25.00mL草酸溶液
②酸化KMnO4溶液的酸应为 ______ .(选填“盐酸”或“稀硫酸”或“稀硝酸”)
③配平离子方程式:_______________________ □MnO4-+□H2C2O4+□H+→□Mn2++□CO2↑+□H2O
④滴定达到终点的标志是 ______ .
![]()
(3)在上述实验中,下列操作一定会造成测定结果偏低的是 ______ .
A.称取13.0g草酸晶体时,将草酸晶体放在托盘天平右盘
B.锥形瓶水洗后未用草酸溶液润洗
C.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
D.盛KMnO4溶液的酸式滴定管尖嘴部分有气泡,滴定后气泡消失.
查看答案和解析>>
科目: 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. MnO2![]() Cl2
Cl2![]() SiCl4
SiCl4
B. Ca(ClO)2![]() HClO
HClO![]() HCl
HCl
C. 浓H2SO4![]() SO2
SO2![]() BaSO4
BaSO4
D. SiO2(s)![]() H2SiO3(胶体)
H2SiO3(胶体)![]() Na2SiO3(aq)
Na2SiO3(aq)
查看答案和解析>>
科目: 来源: 题型:
【题目】向电解质溶液中加入新物质时,其导电性符合图示变化趋势的实验操作是
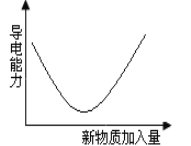
A.NaOH溶液中通入Cl2 至过量
B.硫酸镁溶液中加入Ba(OH)2溶液至过量
C.氨水中加醋酸溶液至过量
D.氯化钠固体加入氯化钾溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= ______
(2)该反应为 ______ 反应(选填“吸热”“放热”).
(3)能判断该反应是否达到化学平衡状态的依据是 ______ .
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合c(CO2)c(H2)=c(CO)c(H2O),试判断此时的温度为 ______ ℃.在此温度下2L密闭容器中进行反应CO2(g)+H2(g)CO(g)+H2O(g),CO2(g)和H2(g)的起始量均为2.0mol,达到平衡时CO2的转化率为 ______ .
(5)在密闭容器中进行反应①Fe(s)+CO2(g)FeO(s)+CO(g)△H1=akJmol-1
反应②2CO(g)+O2(g)2CO2(g)△H2=b kJmol-1
反应③2Fe(s)+O2(g)2FeO(s)△H3
则△H3= ______ (用含a、b的代数式表示).
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为周期表的一部分,表中所列的字母分别代表一种化学元素。回答下列问题:
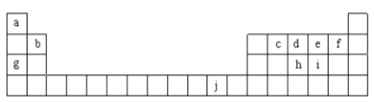
(1)f的基态原子核外电子排布式______。
(2)在c2a4分子中,c为______杂化,c与c间存在的共价键类型有______两种。
(3)ci2与ce2比较,沸点较高的是______(写分子式)。
(4)将氨水滴入到j的硫酸盐溶液中,先产生蓝色沉淀,然后沉淀逐渐溶解并得到深蓝色溶液。深蓝色溶液中是由于存在______(写结构式)
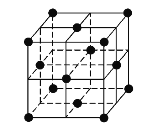
(5)j的金属晶体的晶胞如图所示,则一个晶胞中每个j原子周围与它最接近且距离相等的j共有的个数是______个,已知该元素的相对原子质量为64,单质晶体的密度为ρgcm-3,阿伏加德罗常数的值为NA,试求铜的金属半径为______pm(用含NA、ρ的表达式表达)。
查看答案和解析>>
科目: 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是 ( )


A. 在NaCl晶体中,距Na+最近的Cl-形成正八面体
B. 在CaF2晶体中,每个晶胞平均占有4个Ca2+
C. 在金刚石晶体中,碳原子与碳碳键个数的比为1∶2
D. 该气态团簇分子的分子式为EF或FE
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com