
科目: 来源: 题型:
【题目】已知某温度下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12,当溶液中离子浓度小于1×10-5mol·L-1时,可认为该离子沉淀完全。下列叙述正确的是( )
A. 饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大
B. 向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小
C. 向0.000 8 mol·L-1的K2CrO4溶液中加入等体积的0.002 mol·L-1AgNO3溶液,则CrO42-完全沉淀
D. 将0.001 mol·L-1的AgNO3溶液滴入0.001 mol·L-1的KCl和0.001 mol·L-1的K2CrO4溶液,则先产生AgCl沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应mA(s)+nB(g)![]() eC(g)+fD(g),反应过程中,当其他条件不变时,C的体积分数ψ(C)在不同温度和不同压强的条件下随时间的变化如图所示。
eC(g)+fD(g),反应过程中,当其他条件不变时,C的体积分数ψ(C)在不同温度和不同压强的条件下随时间的变化如图所示。
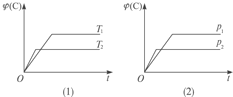
下列叙述正确的是()
A. 平衡后,若使用催化剂,C的体积分数增大
B. 平衡后,若温度升高,化学平衡向正反应方向移动
C. 化学方程式中,化学计量数的关系为n<e+f
D. 平衡后,增加A的质量,化学平衡向正反应方向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成 CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0﹣4 mol/L的KMnO4溶液。
(1)写出用KMn04滴定H2C2O4的离子方程式_____________________。
(2)滴定时,将KMnO4溶液装在________(填“酸式”或“碱式”)滴定管中。
(3)判断滴定终点的方法是________________________。
(4)误差分析:(填“偏高”、“偏低”或“无影响”)
①如果滴定管用蒸馏水洗后未用酸性KMnO4标准液润洗,则测量结果________。
②滴定前后读数都正确,但滴定前有气泡,而滴定后气泡消失,则测量结果________。
(5)计算:血液中含钙离子的浓度为________mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】目前世界上广泛采用氨和二氧化碳高温高压下制备尿素,主要反应为两步:
第一步:生成氨基甲酸铵 | 第二步:氨基甲酸铵脱水生成尿素 |
2NH3(l)+CO2(g) | H2NCOONH4(l)
|
快速放热 | 慢速吸热 |
(1)写出制备尿素的总反应化学方程式:____________________________,该反应热为![]() ,则
,则![]() ______________(“大于”“小于”或“等于”)
______________(“大于”“小于”或“等于”)![]() 。
。
(2)下列说法正确的是________________。
A.利用二氧化碳制备尿素是减缓温室效应的有效方法
B.第二步反应高温条件下自发进行
C.提高投料中的水碳比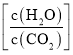 有利于尿素的生成
有利于尿素的生成
D.第一步反应的活化能大于第二步反应
(3)尿素生产过程中转化率通常用二氧化碳转化率来表示,当二氧化碳起始浓度为![]() 时(
时(![]() ,水碳比=0.5),尿素平衡转化率随氨碳比
,水碳比=0.5),尿素平衡转化率随氨碳比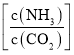 的变化如表所示:
的变化如表所示:
氨碳比/浓度比 | 2.95 | 3.10 | 3.20 | 3.50 |
尿素平衡转化率/% | 56.4 | 57.5 | 57.9 | 60.0 |
提高氨碳比有利于生成尿素,主要有两个原因:一是增大氨气浓度有利于反应正向移动;二是_____________。氨碳比为3.50时,求该状态下的制备尿素总反应平衡常数K=___________.
(4)一定条件下,在图中绘制氨基甲酸铵(![]() )在反应过程中物质的量与时间的关系图。
)在反应过程中物质的量与时间的关系图。
 _______________
_______________
(5)通过直接尿素燃料电池装置,实现了“尿素能”的利用,且产生无污染的产物,写出负极反应:____________________________.

查看答案和解析>>
科目: 来源: 题型:
【题目】无水![]() 的制备流程如下:
的制备流程如下:
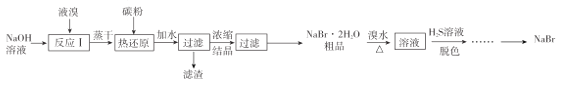
已知:①![]() ;
;
②![]() 溶于
溶于![]() 溶液生成
溶液生成![]() ,离子方程式可表示为
,离子方程式可表示为![]() 。
。
请回答:
(1) “反应I”所用![]() 溶液最好是饱和溶液,理由是____________
溶液最好是饱和溶液,理由是____________
(2)已知“热还原”反应中,氧化剂和还原剂物质的量之比为![]() ,若该反应中消耗了
,若该反应中消耗了![]() 碳粉,则理论上最终可制得
碳粉,则理论上最终可制得![]() 的质量为_____________(不考虑制备过程中的损失)。
的质量为_____________(不考虑制备过程中的损失)。
(3)“脱色”过程中生成了两种强酸,写出该过程的离子方程式:______________________
(4)用![]() 与
与![]() 溶液反应是制备
溶液反应是制备![]() 的另一种方法,反应过程中有气体和沉淀生成,写出此方法的化学方程式:___________________
的另一种方法,反应过程中有气体和沉淀生成,写出此方法的化学方程式:___________________
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列说法错误的是( )
A.常温常压下,1mol甲烷分子中所含质子数为10NA
B.2mol/L的NaCl溶液中钠离数目为2NA
C.常温下,46gNO2和N2O4的混合气体中含有的氮原子数目为NA
D.若120g石墨能写a个字,则平均每个字的含有10NA/a个碳原子
查看答案和解析>>
科目: 来源: 题型:
【题目】苯乙烯是生产塑料和合成橡胶的重要基本有机原料,乙苯催化脱氢法是目前国内外生产苯乙烯的主要方法,其化学方程式为:
![]()
(1)若升高温度,该反应的平衡常数变大,则ΔH_______0(填“大于”或“小于”)。该反应在_______________条件下能自发进行。
(2)维持体系总压强ρ恒定,在温度T时,物质的量为2mol、体积为1L的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为80%,则在该温度下反应的平衡常数K=_____。
(3)在体积为2L的恒温密闭容器中通入2mol乙苯蒸汽,2分钟后达到平衡,测得氢气的浓度是0.5mol/L,则乙苯蒸汽的反应速率为_________________;维持温度和容器体积不变,向上述平衡中再通入1mol氢气和1mol乙苯蒸汽,则v正_______v逆(填“大于”、“小于”或“等于”)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知化合物X是由两种短周期元素和一种长周期元素组成的盐,可溶于水,与酸反应只生成两种盐和水,某学习小组进行了如下实验:
①取![]() ,加入
,加入![]() 的盐酸,无气体产生,得澄清溶液,将其两等分;
的盐酸,无气体产生,得澄清溶液,将其两等分;
②向其中一份溶液中加入过量的![]() 溶液,过滤,得到溶液A和
溶液,过滤,得到溶液A和![]() 白色沉淀B,B是医疗上的胃肠造影剂;
白色沉淀B,B是医疗上的胃肠造影剂;
③向另一份溶液中逐滴加入![]() 的
的![]() 溶液,当
溶液,当![]() 时恰好中和,继续滴加生成白色沉淀,当
时恰好中和,继续滴加生成白色沉淀,当![]() 时,沉淀恰好溶解完全。
时,沉淀恰好溶解完全。
请回答:
(1)化合物X中三种元素对应的简单离子,半径最小的离子结构示意图为___________。
(2)化合物X的化学式为_______________。
(3)将化合物X完全溶于水后,溶液呈强碱性,通入足量![]() ,生成白色沉淀,写出通入足量
,生成白色沉淀,写出通入足量![]() 所发生反应的离子方程式:__________________。
所发生反应的离子方程式:__________________。
(4)设计实验检验溶液A中的阴离子(不考虑水的电离):_______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化碳利用具有十分重要的意义,科学家有以下几个设想。
(1)用太阳能将CO2转化成O2和C(石墨烯),其设想如图:
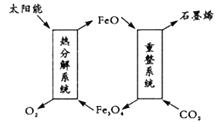
则重整系统发生反应的化学方程式为_________。
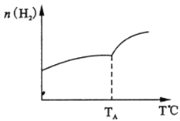
(2)二氧化碳和氢气在催化剂作用下可制取低碳烯烃。在一密闭容器中分别投入1molCO2、3molH2,发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+ 4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。
C2H4(g)+ 4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。
①其它条件不变,起始时若按lmolCO2、2molH2进行投料,CO2转化率将________(填“增大”、“ 减小”或“不变”);
②△H_____0(填“>”“<”“ 不能确定”)。
③若测试中体系内无氧气产生,试结合图示推断热稳定性C2H4 _____H2O (填“>”“<”“ 不能确定”)。
(3)用氨水吸收CO2制化肥(NH4HCO3)
①已知:NH3·H2O(aq)![]() NH4+(aq)+OH-(aq) △H1=akJ/mol
NH4+(aq)+OH-(aq) △H1=akJ/mol
CO2(g)+H2O(l)![]() H2CO3(aq) △H2=bkJ/mol
H2CO3(aq) △H2=bkJ/mol
H2CO3(aq)+OH-(aq)![]() HCO3-(aq)+H2O(l) △H3=ckJ/mol
HCO3-(aq)+H2O(l) △H3=ckJ/mol
则利用NH3 H2O吸收CO2制备NH4HCO3的热化学方程式为______________________;
②已知常温下相关数据如表:
Kb(NH3·H2O) | 2×10-5kJ/mol |
Ka1(H2CO3) | 4×10-7kJ/mol |
Ka2(H2CO3) | 4×10-11kJ/mol |
则反应NH4++HCO3-+H2O![]() NH3 H2O+H2CO3的平衡常数K=___________。
NH3 H2O+H2CO3的平衡常数K=___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素A、B、C、D在元素周期表中的相对位置如表所示,已知A原子最外层电子数与次外层电子数之比为2:1。E和C、D同周期,它的原子序数比B多6。
回答下列问题:
A | B | ||
C | D |
(1)人的汗液中含有D的简单离子,其离子结构示意图为______,元素C在元素周期表中的位置是______。C的最高价氧化物的水化物的浓溶液稀释的方法是______。
(2)A的最高价氧化物的化学式为_____,所含的化学键类型是______(填“离子键”或“共价键”)。
(3)E的最高价氧化物对应的水化物的化学式为____,它是______(填“酸性”或“两性”或“碱性”)化合物。写出该化合物与氢氧化钠溶液反应的离子方程式______。
(4)加热时,B的最高价氧化物对应水合物的浓溶液与单质A反应的化学方程式为(用具体的化学式表示)______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com