
科目: 来源: 题型:
【题目】无论以何种比例混合的10mL混和气,在50mL的氧气中燃烧生成CO2和液态的H2O,燃烧后所得气体的体积为35mL,则该混合物可能为
A. C3H6 C4H6 B. C2H6 C3H6
C. C2H4 C3H8 D. C2H2 C2H6
查看答案和解析>>
科目: 来源: 题型:
【题目】以丁烯二醛和肼为原料经过DielsAlder反应合成哒嗪,合成关系如图:
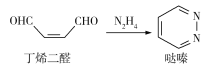
下列说法正确的是
A. 哒嗪与氢气加成后的产物分子式为C4H6N2
B. 聚丁烯二醛因无碳碳双键不能使溴水褪色
C. 丁烯二醛与N2H4可以在一定条件下加成后再消去可制得哒嗪
D. 物质的量相等的丁烯二醛和哒嗪分别与氢气完全加成,消耗氢气的量不同
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质分离提纯的方法不正确的是( )
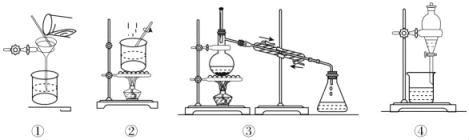
A. 提纯工业乙醇(含甲醇、水等杂质)的装置:③
B. 提纯粗苯甲酸选择装置:②①
C. 提纯粗苯甲酸三个步骤:加热溶解、趁热过滤、冷却结晶
D. 苯中混有少量苯酚选择装置:④
查看答案和解析>>
科目: 来源: 题型:
【题目】已知,常温下,有氧化还原反应(未配平):HFeO4-+(NH2)2CS+H2O→Fe(OH)3+(NH2)2CO+SO42-+OH,下列有关说法正确的是
A. HFeO4-为还原剂,Fe(OH)3为氧化产物
B. 氧化剂与还原剂反应的物质的量之比为4∶3
C. 随着反应的进行,溶液中c(H+)/Kw逐渐变小
D. 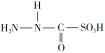 为此反应的中间产物,其中碳元素的化合价为0价
为此反应的中间产物,其中碳元素的化合价为0价
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生用0.10 mol/L标准NaOH溶液滴定某浓度的盐酸。记录数据如下:
实验编号 | NaOH溶液的浓度(mol/L) | 消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 19.98 | 20.00 |
2 | 0.10 | 20.02 | 20.00 |
3 | 0.10 | 20.00 | 20.00 |
(1)滴定时可用的指示剂是__________________。
A.品红溶液 B.酚酞试液 C.石蕊试液
(2)排去碱式滴定管中气泡的方法应采用操作_________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(3)滴定操作时,眼睛应注视____________________________________________。
(4)滴定达到终点的现象____________________________________________________。
(5)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是_______(填“偏高”或“偏低”或“不影响”,下同);碱式滴定管滴定前仰视滴定后俯视,对测定结果的影响是_______;锥形瓶用水洗净后没用酸润洗,结果会________。
(6)根据上述数据,计算出该盐酸的浓度约为__________________(保留两位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下面a~f是中学化学实验中常见的几种仪器:
a 量筒 b 容量瓶 c 托盘天平 d 温度计 e 分液漏斗
(1)标出仪器使用温度的是________(填写编号)。
(2)使用前需要检查是否漏水的是________(填写编号)。
(3)称取10.5 g固体样品(1 g以下使用游码)若样品与砝码错放位置,则实际称取的样品质量为________ g。
(4)在某次实验中,要用500mL 0.52mol·L-1的NaOH溶液, 配制此浓度NaOH溶液时需用的主要仪器有托盘天平(附砝码、镊子)、药匙、量筒、烧杯、玻璃棒、_________和___________;
(5)下列操作使所配物质的量浓度偏大的有__________(填写字母)。
A 称量时用了生锈的砝码;
B 将NaOH放在托盘天平的右盘上称量(使用游码);
C NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中;
D 往容量瓶转移时,有少量液体溅出;
E 定容时俯视刻度线;
F 容量瓶未干燥即用来配制溶液;
G 定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
(6) 实验室用密度为1.25g·mL-1,质量分数为36.5%的浓盐酸配制240mL0.1mol ·L-1的盐酸.
请回答下列问题:
(1)浓盐酸的物质的量浓度为________。
(2)配制240mL 0.1mol·L-1的盐酸应量取浓盐酸体积______mL,应选用容量瓶的规格是______mL.
查看答案和解析>>
科目: 来源: 题型:
【题目】在如图所示的串联装置中,发现灯泡不亮,但若向其中一个烧杯加水,则灯泡会亮起来:
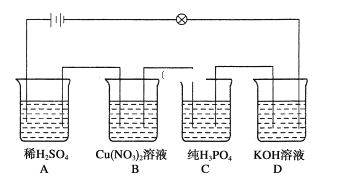
则:(1)加水的烧杯为__________。
(2)写出下列离子方程式:
硝酸铜溶液与氢氧化钾溶液混合_________,稀硫酸溶液与碳酸钠溶液混合_________
(3)若在A烧杯中加入Ba(OH)2溶液后,溶液的导电性________。(填“变强”“变弱”“不变”)
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。请回答下列问题:

(1)甲池为__________(填“原电池”、“电解池”或“电镀池”),A电极的电极反应式为___________________________。
(2)丙池中F电极为_________(填“正极”、“负极”、“阴极”或“阳极”),F电极的电极反应式为_________________________________。该池总反应的化学方程式为___________________________。
(3)当乙池中C极质量减轻10.8 g时,甲池中B电极理论上消耗O2的体积为_____mL(标准状况)。
(4)一段时间后,断开电键K,下列物质能使丙池恢复到反应前浓度的是___(填选项字母)。
A.Cu B.CuO C.Cu(OH)2 D.Cu2(OH)2CO3
查看答案和解析>>
科目: 来源: 题型:
【题目】① NaOH ② CH3COOH ③ NaHCO3 ④ HCl溶液是中学化学中常用的四种物质。
(1)pH相同的CH3COOH和HCl溶液比较,物质的量浓度较大的是____(填序号)。
(2)等体积、等物质的量浓度的CH3COOH和HCl溶液与足量的NaHCO3固体粉末反应,起始反应速率较小的是_______填序号)。
(3)常温下,pH均为10的 NaOH和NaHCO3 溶液,由水电离出的c(OH—)之比为_________________。
(4)常温下,用 0.10 mol/L NaOH溶液滴定 20.00 mL 0.10 mol/L CH3COOH溶液,
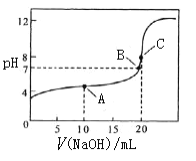
①A点溶质为____________(写化学式),此时c(CH3COO-)_______c(CH3COOH)(填“大于” 、“小于”或“等于”),溶液中水的电离平衡______(填“被抑制”或“被促进”或“无影响”)
②结合化学用语,解释C点pH=8的原因_______________________________________ 。
③下列关于B点的判断正确的是____
a.醋酸和氢氧化钠恰好完全反应
b.混合液中的微粒种类共四种
c.c(CH3COO-) = c(Na+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com