
科目: 来源: 题型:
【题目】(1)同温同压下,同体积的甲烷(CH4)和二氧化碳物质的量之比为__________,原子总数之比为__________,密度之比为__________。
(2)在标准状况下,4 g H2、11.2 L O2、1 mol H2O中,所含分子数最多的是__________,质量最大的是__________,体积最小的是__________。
(3)标况下,1.92 g 某气体的体积为 672 mL,则此气体的相对分子质量为_____。
(4)已知某硫酸溶液的密度为 1.84 g/cm3,质量分数为 98%,则该硫酸的物质的量浓度为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如下图所示的装置中,A是氯气发生装置,C、D 为气体净化装置(C中装有饱和食盐水;D 中装有浓硫酸),E 是硬质玻璃管装有细铁丝网,F为干燥的空广口瓶,烧杯G 中装有氢氧化钠溶液。

试回答:
(1)实验室制氯气的化学方程式:_______________________________;
(2)C装置的作用是________________;D 装置的作用是__________________;E中发生化学反应的方程式为:_____________________________。
(3)烧杯G 中装有氢氧化钠溶液的作用是___________________;
查看答案和解析>>
科目: 来源: 题型:
【题目】已知以下三个氧化还原反应的化学方程式:
①2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
②2Al+Fe2O3![]() Al2O3+2Fe
Al2O3+2Fe
③2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
(1)反应①中氧化剂为________,还原剂为________。
(2)反应②中该反应中Fe2O3发生了________反应,Al发生了________反应。
(3)反应③中每生成1molO2,转移电子的物质的量是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答下列问题。
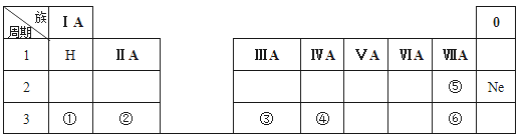
(1)元素④的符号是_______;②的最高价氧化物对应水化物的化学式为_______;⑤和⑥两种元素原子半径的大小关系:⑤_____⑥(填“>”或“<”);
(2)①和②两种元素金属性强弱关系:①_____②(填“>”或“<”);
(3)①的最高价氧化物的水化物与元素③的单质反应的化学方程式为:___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家发现对冶金硅进行电解精炼提纯可降低高纯硅制备成本。相关电解槽装置如图所示,用Cu-Si合金作硅源,在950℃利用三层液熔盐进行电解精炼,有关说法正确的是

A.电子由液态Cu-Si合金流出,流入液态铝电极
B.液态铝电极与正极相连,作为电解池的阳极
C.在该液相熔体中Cu优先于Si被氧化,Si4+优先于Cu2+被还原
D.三层液熔盐的作用是使电子能够在三层间自由流动
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 3mol单质Fe在纯氧中完全燃烧,失去8NA个电子
B. 1molCu和足量热浓硫酸充分反应可生成NA个SO3分子
C. 标准状况下,22.4L N2和H2的混合气体中含有NA个原子
D. 78g Na2O2中含共价键数目为2NA个
查看答案和解析>>
科目: 来源: 题型:
【题目】严重雾霾天气的产生与汽车排放的NO2(N2O4)、CO、NO等气体有关。回答下列问题:
(1)用活性炭对尾气进行处理,发生如下反应:
反应a:C(s)+NO2(g)![]() 1/2N2(g)+CO2(g) ΔH=-32.1kJ·mol1
1/2N2(g)+CO2(g) ΔH=-32.1kJ·mol1
反应b:2C(s)+N2O4(g)![]() N2(g)+2CO2(g) ΔH=-28.2kJ·mol1
N2(g)+2CO2(g) ΔH=-28.2kJ·mol1
则NO2生成N2O4的热化学方程式为____。
(2)用活性炭处理尾气时还可发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=-34.0 kJ·mol1,借助传感器在T1℃测得不同时间点上NO和N2的浓度如下:
N2(g)+CO2(g) ΔH=-34.0 kJ·mol1,借助传感器在T1℃测得不同时间点上NO和N2的浓度如下:
时间/min 浓度/mol·L1 物质 | 0 | 5 | 10 | 15 | 20 | 25 |
NO | 1.20 | 0.74 | 0.56 | 0.56 | 0.63 | 0.63 |
N2 | 0 | 0.23 | 0.32 | 0.32 | 0.36 | 0.36 /td> |
①15 min后,只改变某一条件,反应重新达到平衡;根据上表数据判断改变的条件可能是___(填字母)。
a.适当缩小容器的体积 b.加入适量的活性炭
c.通入适量的NO d.适当升高温度
②0~10 min内,CO2的平均反应速率v(CO2)=___。
(3)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在密闭容器中加入足量的C和一定量的N2O4气体,维持温度T2℃,在不同压强下发生(1)中反应b,经过相同时间N2O4的转化率随压强变化如图所示:

在1.1×106 Pa时该反应的化学平衡常数Kp=___(结果保留两位有效数字。已知:气体分压(p分)=气体总压(p总)×体积分数)。
(4)用I2O5吸收汽车尾气中的CO,发生I2O5(s)+5CO(g)![]() 5CO2(g)+I2(g) ΔH=Q,在容积为1 L的密闭容器中充入5 mol CO和足量的I2O5模拟该反应。
5CO2(g)+I2(g) ΔH=Q,在容积为1 L的密闭容器中充入5 mol CO和足量的I2O5模拟该反应。
①测得CO的平衡转化率随温度变化的关系如图,下列说法正确的是____(填字母)。

A.Q<0
B.从X点到Y点可通过通入CO实现
C.从Y点到Z点可通过增大压强实现
D.600 K时,Y点CO的v正<v逆
②已知Y点的坐标为(600K,0.6),在此条件下I2(g)的体积分数为___。(精确到0.1%)
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.MgH2拥有很高的储氢密度,相对便宜的价格以及良好的可逆储氢性能,在储氢材料中具有重要作用和地位,一直都是广大研究者关注的焦点。回答下列问题:
(1)请写出MgH2的电子式:____。
(2)MgH2能与H2O反应生成白色沉淀Mg(OH)2和H2,NH3与H2O类似,MgH2与NH3反应也生成氢气,反应原理类似,请写出反应的化学方程式:____。
Ⅱ.(3)尿素(H2NCONH2)水解生成H2NCOONH4(氨基甲酸铵,简称甲铵),甲铵不稳定,迅速分解生成两种气态化合物,溶于水后,一个呈酸性,一个呈碱性,请写出甲铵受热分解的化学方程式:____。
(4)甲铵在不同条件下分解的能量变化如图所示,N过程与M过程相比,N过程活化能大大降低的原因可能是____;ΔH=___kJ·mol1。

Ⅲ.氨呈弱碱性,氨燃料与碱性燃料电池是一对较好的组合。直接氨碱性(膜)燃料电池总的化学方程式为:4NH3+3O2=2N2+6H2O,工作原理如图:
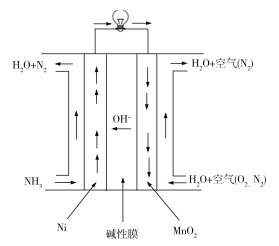
(5)MnO2电极为__极(填“正”“负”“阴”或“阳”),写出Ni电极的电极反应式:____。
查看答案和解析>>
科目: 来源: 题型:
【题目】K2FeO4是一种集氧化、吸附、絮凝、消毒、杀菌、除臭等功能于一体的绿色高效水处理剂,已成为多个领域不可短缺的物质之一,工业制备工艺如图所示,回答下列问题:

(1)在湿法制备Na2FeO4工艺中,请写出氯碱工业过程中用惰性电极电解饱和NaCl溶液的离子方程式:___;NaClO与FeCl3在碱性条件下制备Na2FeO4的反应中被氧化的原子与被还原的原子个数比为____;可循环使用的物质为___(任写一种)。
(2)电解法制备Na2FeO4工艺中,阳极材料为铁平板,在使用前要经过粗砂和细砂打磨抛光,其目的为____;钛合金材料作阴极,电解质溶液为NaOH溶液,请写出阳极电极反应式:____。
(3)干法制备Na2FeO4工艺是最早发现的制备工艺,请写出NaClO固体、Fe(NO3)3·9H2O晶体、NaOH固体在高温熔融的条件下制备Na2FeO4的化学方程式:_____。
(4)请写出由Na2FeO4制备K2FeO4的化学方程式:____;请说明该反应能发生的原因:____。
(5)粗K2FeO4提纯时用-5℃饱和KOH的原因____;K2FeO4是绿色水处理剂,能对水起到杀菌、消毒,又能起到净水的作用,其原因为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】铜与稀硝酸反应制备NO是化学实验教学中的重要实验之一,但是由于反应进度不易控制、NO易被氧化以及容易造成空气污染等原因在教学实践中不易操作,如图为该实验进行改进示意图。回答下列问题:

(1)组装实验装置并检验装置的气密性,检验气密性的方法为___。
(2)如果该装置气密性良好,如图装好药品,并能保证B中的两根玻璃导管能穿过塑料隔板,然后在塑料隔板上添加铜片,在反应发生前需要进行的必要操作为:打开试管C上部的止水夹,从A口通入__气体,当__时,停止从A口通气体,并用止水夹夹住A口的橡胶管。
(3)引发Cu与稀HNO3反应发生的操作:__。
(4)B中的实验现象:___。
(5)简述使实验停止的操作:___。
(6)实现无色气体迅速变为红棕色的操作:____。
(7)澄清石灰水和蘸有NaOH溶液的棉花团都可以吸收尾气,若NaOH溶液吸收NO和NO2混合气体后无气体剩余,请写出发生反应的离子方程式:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com