
科目: 来源: 题型:
【题目】为研究某溶液中溶质R的分解速率的影响因素,分别用三份不同初始浓度的R溶液在不同温度下进行实验,c(R)随时间变化如图。下列说法不正确的是( )
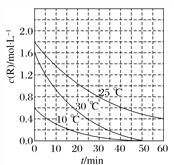
A. 25 ℃时,在0~30 min内,R的分解平均速度为0.033 mol·L-1·min-1
B. 对比30 ℃和10 ℃曲线,在50 min时,R的分解百分率相等
C. 对比30 ℃和25 ℃曲线,在0~50 min内,能说明R的分解平均速度随温度升高而增大
D. 对比30 ℃和10 ℃曲线,在同一时刻,能说明R的分解速率随温度升高而增大
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家近期研发出如图所示的水溶液锂离子电池体系,下列有关叙述错误的是
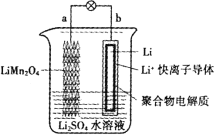
A.b电极不可用石墨替代Li
B.正极反应为:Li1-xMn2O4+xLi++xe- = LiMn2O4
C.电池总反应为:Li1-xMn2O4+xLi = LiMn2O4
D.放电时,溶液中Li+从a向b迁移
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B均是由两种元素组成的化合物,A中某种元素的质量分数为75% ,B是一种淡黄色固体,C、J是同周期元素的气态氢化物,其中C是含氢量最高的烃,X为无色液体。反应生成的水均已略去。它们有如下图所示的关系。

(1)写出化学式:A___________B____________J_____________。
(2)反应③中每生成1molF,转移电子的数目为:___________。
(3)反应④的化学方程式为:________________________________________________。
(4)离子方程式分别为:反应②__________________________________________;
⑤__________________________________________________________。
(5)反应①中,每1.00gC与足量的F作用,恢复到25℃放出55.6kJ热量,写出反应①的热化学方程式__________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某厂废水中含5.00×10-3mol·L-1的![]() ,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料
,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料![]() (
(![]() 的化合价依次为+3、+2),设计了如下实验流程:
的化合价依次为+3、+2),设计了如下实验流程:
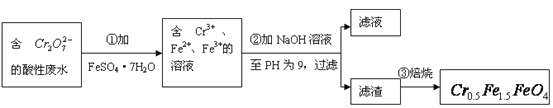
(1)第①步反应的离子方程式是_________________________________________________;
(2)第②步中用pH试纸测定溶液pH的操作是:
______________________________________________________________________________;
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有______________________;
(4)欲使1L该废水中的![]() 完全转化为
完全转化为![]() 。理论上需要加入__________g FeSO4·7H2O。
。理论上需要加入__________g FeSO4·7H2O。
查看答案和解析>>
科目: 来源: 题型:
【题目】厨房垃圾发酵液可通过电渗析法处理,同时得到乳酸。原理如图所示(图中HA表示乳酸分子,A-表示乳酸根离子,乳酸的摩尔质量为90g/mol,下列有关说法中正确的是( )

A. 电极a为阴极,放出H2
B. 通电一段时间后,硫酸溶液的pH升高
C. A-通过阴离子交换膜从阴极进入浓缩室
D. 对400mLl0g/L乳酸溶液通电后,当外电路通过0.5mole-时浓度,上升为145g.L-1(溶液体积变化忽略不计)
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g) 达到平衡。下列说法正确的是
CH3OH(g) 达到平衡。下列说法正确的是
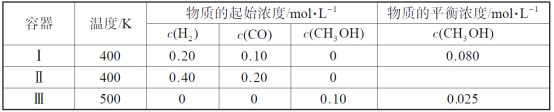
A.该反应的正反应吸热
B.达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C.达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D.达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
查看答案和解析>>
科目: 来源: 题型:
【题目】In是第5周期ⅢA的元素;In2O3是一种透明的导电材料,可运用于触控屏、液晶显示器等高科技领域;利用水铟矿(主要成分In(OH)3),制备In2O3的工艺流程如下:
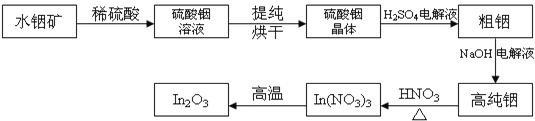
(1)写出水铟矿被硫酸酸溶的离子方程式:_____________________________。
(2)从硫酸铟溶液中制备硫酸铟晶体的实验步骤:___、___、过滤、洗涤和干燥。
(3)提纯粗铟的方法和铜的精炼原理相似,则粗铟为___(填“阴极”、“阳极”),写出阴极的电极反应式___________________________________。
(4)完成下列化学方程式:___In(NO3)3![]() ___In2O3+___↑+___↑。
___In2O3+___↑+___↑。
(5)高纯铟和浓硝酸反应过程中产生的NO2气体可以被Na2O2直接吸收,则标准状况下672mLNO2可以被___gNa2O2吸收。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列化合物:①NaOH,②H2SO4,③CH3COOH,④NaCl,⑤CH3COONa,⑥NH4Cl,⑦CH3COONH4,⑧NH4HSO4,⑨NH3H2O,请回答下列问题:
(1)NH4Cl溶液中离子浓度大小顺序为______________________。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH﹣)=_____;在pH=3的CH3COOH溶液中,水电离出来的c(H+)=_____。
(3)已知水存在如下平衡:H2O+H2O![]() H3O++OH﹣△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是_____。
H3O++OH﹣△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是_____。
A.向水中加入NaHSO4固体 B.向水中加NaHCO3固体
C.加热至100℃[其中c(H+)=1×10﹣6mol/L] D.向水中加入NH4Cl固体
(4)若浓度均为0.1mol/L、等体积的NaOH和NH3H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则 m_____n(填“<”、“>”或“=”)。
(5)物质的量浓度相同的⑥、⑦、⑧、⑨四种稀溶液中,NH4+浓度由大到小的顺序是(填序号)_____。
(6)已知t℃时,Kw=1×10-12,在该温度时将pH=9的NaOH溶液aL与pH=2的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=3,则a:b=_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列选项的编号和曲线的编号一一对应,其中描述错误的是

A. 向NaAlO2溶液中逐渐滴入HCl至过量
B. 向澄清石灰水中通入CO2至过量
C. 向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量
D. 向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至过量
查看答案和解析>>
科目: 来源: 题型:
【题目】将a克Fe2O3、Al2O3样品溶解在过量的200mL pH=1的硫酸溶液中,然后向其中加入NaOH 溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH 溶液100 mL,则NaOH 溶液的浓度为
A. 0.1 mol/LB. 0.2 mol/LC. 0.4 mol/LD. 0.8 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com