
科目: 来源: 题型:
【题目】(1)钒是第四周期元素,工业上有广泛应用。写出钒原子的价电子排布图______________,V2O5常用作SO2转化为SO3的催化剂,S单质的常见形式为S8,其环状结构如图所示,S原子的杂化轨道类型为_________________.
![]()
(2)光气(COCl2)是一种重要的有机中间体,其分子的立体构型为_________,其三种元素的电负性由小到大的顺序为___________________,写出与COCl2互为等电子体的分子和离子:___(各写一种)。
(3)[Co(N3)(NH3)5]SO4中Co的配位数为_________,其配离子中含有的化学键类型为__________,C、N、O中第一电离能最大的为_______,其原因是____________________。
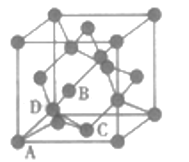
(4)如图为金刚石的晶胞,其中原子坐标参数为A(0,0,0);B(![]() ,0,
,0,![]() );C(
);C(![]() ,
,![]() ,
,![]() );则D原子的坐标参数为__________。
);则D原子的坐标参数为__________。
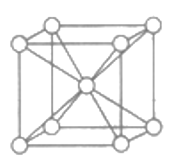
(5)晶体锌为体心立方结构,如图所示。已知锌晶体的密度为dg/cm3,NA代表阿伏加德罗常数的值。锌晶体中锌原子之间最近的核间距(D)=_______mm。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国化学家侯德榜根据NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl都小的性质,运用CO2 + NH3 + H2O + NaCl = NaHCO3↓+ NH4Cl的反应原理制备纯碱。下面是在实验室进行模拟实验的生产流程示意图:

则下列叙述错误的是( )
A.A气体是NH3,B气体是CO2
B.第Ⅲ步得到的晶体是发酵粉的主要成分
C.第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒
D.第Ⅳ步操作的主要过程有溶解、蒸发、结晶
查看答案和解析>>
科目: 来源: 题型:
【题目】欲配制0.2mol/L 的NaOH溶液980mL,有以下仪器:
①烧杯 ②100mL量筒 ③托盘天平(带砝码) ④玻璃棒 ⑤胶头滴管
(1)配制时,必须使用的仪器有___________(填代号),还缺少的玻璃仪器是 ________。该实验中两次用到玻璃棒,其作用分别是_______________,_________________。
(2)使用容量瓶前必须进行的一步操作是_____________________。
(3)配制溶液时,一般可以分为以下几个步骤:正确的操作顺序是:_______________(用字母表示,每个字母只能用一次);
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.用托盘天平准确称取所需的NaOH固体的质量,放入烧杯中,再加入少量水,用玻璃棒慢慢搅动,使其充分溶解
C.将已冷却的溶液沿玻璃棒注入1000mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
在①操作中需称量NaOH_______g
(4)请你分析下列哪些操作会引起所配浓度偏大(填写字母)___________________。
A.将NaOH放在滤纸上称量
B.称取NaOH的砝码已生锈
C.容量瓶未干燥即用来配制溶液
D.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,并进行定容;
E.往容量瓶转移时,有少量液体溅出
F.在容量瓶中定容时视线如下图所示

G.烧杯未进行洗涤
H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
(5)若定容时不小心使液面超过了刻度线,应采取的措施是_______________
查看答案和解析>>
科目: 来源: 题型:
【题目】硝酸工业与合成氨工业密切相关,氨氧化法是工业生产中制取硝酸的主要途径,其主要流程如图:
I. 在一容积为2L的密闭容器内加入2molN2和6molH2,在一定条件下合成氨气,已知N2(g)+3H2(g)![]() 2NH3 △H<0。反应中NH3的物质的量浓度的变化情况如图所示
2NH3 △H<0。反应中NH3的物质的量浓度的变化情况如图所示

(1)根据图示,计算从反应开始到第4分钟达到平衡时,平均反应速率υ(N2)为______
(2)达到平衡后,第5分钟末,若保持其它条件不变,只改变反应温度,则NH3的物质的量浓度不可能为________(填序号)。
a. 0. 8mol/L b.1.0mol/L. c.1.2mol/L d. 2. mol/L
(3)达到平衡后,第5分钟末,若保持其它条件不变,只把容器的体积缩小,新平衡时NH3的浓度恰好为原来的2倍,则新体积_________(选填“大于”“等于”或“小于”)二分之一倍的原体积。
Ⅱ.某小组同学欲探究由NH3制取HNO3的过程,设计按如图所示装置进行试验。
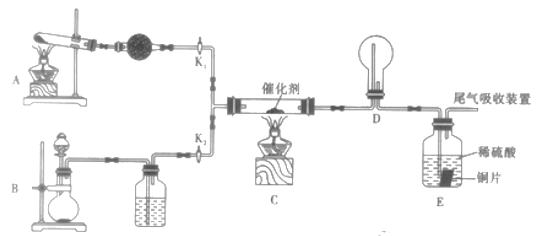
(1)A装置中发生反应的化学方程式为_________________________________。
(2)B装置制备的物质为_________________。(填序号)
A . NH3 B Cl2 C.O2 D. HCl
(3)该实验中能够证明有二氧化氮产生的现象为_______________________。
(4)已知E中装有2mol/L的硫酸150mL和足量铜片,若E中出现溶液变蓝色的现象,所有反应的铜均转化为CuSO4,则至少需要产生标况下_______L氨气(假设各步反应均完全进行)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)现有以下物质①熔融状态的NaCl ②NH3·H2O ③Na2O固体 ④铜 ⑤BaSO4固体 ⑥酒精 ⑦液态HCl ⑧KNO3溶液,其中属于电解质的是:___________;该状态下能导电的是_____________;属于非电解质的是_________________。(请用序号作答)
(2)以下A~D四个涉及H2O2的反应,请填空:
A. Na2O2+ 2HCl=H2O2+2NaCl B. Ag2O+H2O2=2Ag+O2↑+H2O
C. 2H2O2=2H2O+O2↑ D. □H2O2+□KMnO4+□H2SO4→□MnSO4+□K2SO4+□H2O+□O2↑
①配平D方程式,系数填在方框内____;该反应的还原剂是_________________;
②H2O2既体现氧化性,又体现还原性的反应是________,H2O2既不作氧化剂又不作还原剂的反应是__________。(请用代号作答)
③请用双线桥法表示B反应中电子转移的方向和数目:___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求完成下列填空
(1)写出下列物质在水溶液中的电离方程式:
NaHCO3__________________
KHSO4________________________________________________
CH3COOH____________________________
Al(OH)3 ________________
(2)写出下列反应的离子方程式:
稀盐酸与碳酸钙反应_____________
氢氧化铜溶液与稀硫酸反应______________
氯气和水反应_____________
氧化镁与稀硫酸反应_________________
(3)写出与下列离子方程式相对应的化学方程式:
H+ + OH- =H2O _____________
CO32- + 2H+=CO2↑+ H2O_______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在3个体积均为1 L的恒容密闭容器中发生反应:SO2(g)+2NO(g)![]() 2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是
2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是


A. 该反应的ΔH<0
B. T1时,该反应的平衡常数为![]()
C. 容器Ⅰ与容器Ⅱ均在T1时达到平衡,总压强之比小于1:2
D. 若T2<T1,达到平衡时,容器Ⅲ中NO的体积分数小于40%
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关《化学反应原理》的内容说法不正确的是
A. 应用盖斯定律,可计算某些难以直接测量的反应的焓变
B. 向FeCl3与CuCl2溶液中加入碱式碳酸铜调节pH可以除去溶液中的FeCl3
C. 使用催化剂,可以增大活化分子百分数,加快反应速率
D. 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可。
查看答案和解析>>
科目: 来源: 题型:
【题目】有下列反应:
①Fe+CuSO4=Cu+FeSO4
②CaO+H2O=Ca(OH)2
③Ba(OH)2+H2SO4 =BaSO4↓+2H2O
④Zn+2HCl=ZnCl2+H2↑
⑤2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
⑥CaCO3![]() CaO+CO2↑
CaO+CO2↑
⑦2CO+O2![]() 2CO2
2CO2
⑧SO42-+Ba2+=BaSO4↓
(1)反应①中,氧化剂是______________________。
(2)反应③的离子反应方程式为_________________________________________。
(3)写出一个符合⑧的化学反应方程式___________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 2L 0.5mol/L亚硫酸溶液中含有的H+离子数为2NA
B. 室温下,1L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C. 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g
D. 某密闭容器中盛有0.1mol N2和0.3mol H2,在一定条件下充分反应,转移电子的数目小于0.6NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com