
科目: 来源: 题型:
【题目】第二周期是非金属元素最多的周期,回答下列问题。
(1)在硼酸分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。则同层分子间的主要作用力是___________________
(2)第一电离能介于B、N之间的第二周期元素有_________________种。
(3)HNO3的酸性比HNO2强,试从结构的角度解释其原因_____________________
(4)碳与硅同主族,晶体硅的结构同金刚石相同,推测硅的熔点比金刚石的________(高、低)。设硅原子的半径为r,则硅晶体晶胞的棱长为_______________(用带r的算式表示),晶胞的空间利用率为______________(保留两位有效数字)
(5)石墨烯与金属R可以形成一种插层化合物。其中R层平行于石墨层,晶胞如图甲所示,其垂直于石墨层方向的投影如图乙所示。则该插层化合物的化学式为_____;

查看答案和解析>>
科目: 来源: 题型:
【题目】铁及其化合物有重要且广泛的应用
(1)基态Fe2+的价层电子排布图为_____________
(2)检验Fe3+可以用KSCN溶液,写出SCN-的一种等电子体分子_______。
(3)部分电离能数据如下表:
元素 | Mn | Fe | |
电离能 |
| 717 | 759 |
| 1 509 | 1 561 | |
| 3 248 | 2 957 | |
根据表中数据可知,气态![]() 再失去一个电子比气态
再失去一个电子比气态![]() 再失去一个电子难,其原因是___________________________。
再失去一个电子难,其原因是___________________________。
(4)过渡金属原子可以与CO分子形成配合物,配合物价电子总数符合“18电子规则”。如Cr可以与CO形成![]() 分子:价电子总数
分子:价电子总数![]() 的价电子数
的价电子数![]() 提供电子数
提供电子数![]() .Fe原子也能与CO形成配合物,其化学式为________.
.Fe原子也能与CO形成配合物,其化学式为________.
(5)已知Fe单质有如图所示的两种常见堆积方式:


其中属于体心立方密堆积的是______![]() 填“a”或“b”
填“a”或“b”![]() ;若单质Fe按a方式紧密堆积,设原子半径为rpm,图中晶胞的棱长为_________
;若单质Fe按a方式紧密堆积,设原子半径为rpm,图中晶胞的棱长为_________
(6)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3。
查看答案和解析>>
科目: 来源: 题型:
【题目】Co、Ni的化合物在生产生活中有着广泛的应用。
(1)![]() 元素在周期表中的位置是4周期,_________族。基态Co原子的电子排布式为____________。
元素在周期表中的位置是4周期,_________族。基态Co原子的电子排布式为____________。
(2)乙二胺NH2-CH2-CH2-NH2(缩写符号en)中N原子的杂化方式为________杂化。en可以与Co形成配合物[Co(en)2Cl2]Cl·HCl·2H2O,配离子结构如下图所示,中心离子的配位数为________,配合物晶体中可能存在的作用力有___________。
A、离子键 B、极性共价键 C、非极性共价键 D、配位键 E、氢键

(3)NiO晶体结构如图1所示,其中离子坐标参数A为(0,0,0),B为(![]() ),则C离子(面心处)坐标参数为_______________。
),则C离子(面心处)坐标参数为_______________。

(4)天然氧化镍晶体中总是存在晶体缺陷,如图2所示。NiXO晶体中x值为![]() ,若晶体中的Ni分别为
,若晶体中的Ni分别为![]() 、
、![]() ,此晶体中
,此晶体中![]() 与
与![]() 的最简整数比为______。
的最简整数比为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】O2、O3、N2、N4是氧和氮元素的几种单质。回答下列问题:
(1)O原子中价电子占据的轨道数目为______________。
(2)第一电离能I1:N__________O(填“>”或“<”),第二电离能I2:O大于N的原因是_________________。
(3)O3的空间构型为__________________;分子中存在大π键,可用符号Π![]() 表示,其中m表示形成的大π键的原子数,n表示形成的大π键的电子数,则O3中大π键应表示为___________________________________。
表示,其中m表示形成的大π键的原子数,n表示形成的大π键的电子数,则O3中大π键应表示为___________________________________。
(4)N元素的简单气态氢化物NH3在H2O中溶解度很大,其原因之一是NH3和H2O可以形成分子间氢键,则在氨水中氢键可以表示为H3N…H—N、____________________、__________________________(任写两种即可)。
(5)已知:表格中键能和键长数目。
化学键 | 键长/pm | 键能/(kJ·mol-1) |
N-N | 145 | 193 |
N=N | 125 | 418 |
N≡N | 110 | 946 |
N2和N4都是N元素的单质,其中N4是正四面体构型,N原子占据四面体的四个顶点,从键参数角度分析N4分子稳定性远小于N2原因是________________________。
(6)Na2O的晶胞结构如图所示 ,X表示O2-,Y表示Na+,则O2-的配位数为____________,该晶胞的原子空间利用率为_____________。[已知该晶胞的棱长为a pm,r(Na+)=x pm,r(O2-)=y pm]
,X表示O2-,Y表示Na+,则O2-的配位数为____________,该晶胞的原子空间利用率为_____________。[已知该晶胞的棱长为a pm,r(Na+)=x pm,r(O2-)=y pm]
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化亚砜(SOCl2)是一种液态化合物,在农药、制药行业中用途广泛。实验室合成原理为:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,回答以下问题:

已知:①SOCl2沸点为78.8℃,SCl2 的沸点为50℃,且两种液体可互溶。
②SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的有气体产生。
(1)实验室制取SOCl2在三颈烧瓶中进行,整个装置所选仪器的连接顺序是:⑥→__________→①,②←______________(某些仪器可以多次使用)。
(2)仪器a的名称是________,仪器b的作用是____________。
(3)本实验中制Cl2的离子方程式为___________________,本实验中制SO2的化学方程式为______________________,SOCl2与水反应的化学方程式为___________。
(4)实验结束后,从三颈烧瓶分离出SOCl2的实验操作名称是_________________。若反应中消耗Cl2的体积为896 mL(标准状况,SO2足量),最后得到纯净的SOCl2 7.14 g,则SOCl2的产率为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】电解质溶于水时会发生电离产生自由移动的离子,电导率变化一定程度上可以反映溶液中自由移动的离子浓度变化。溶液中自由移动的离子浓度越大,电导率就越大。如图是向20mL0.01mol/LBa(OH)2溶液中滴入了2滴酚酞溶液,然后向Ba(OH)2溶液中匀速滴加0.2mol/LH2SO4溶液,获得电导率随时间变化的曲线图。
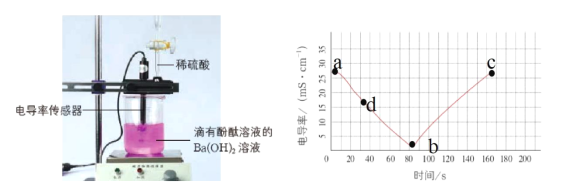
(1)0-80s观察到的实验现象是_____。
(2)写出该实验中的离子方程式_____。
(3)截至b点,加入0.2molL-1H2SO4溶液的体积为_____mL,解释b点的电导率不等于零和bc段电导率又增加的原因____。
(4)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析正确的是(_____)(多选题)
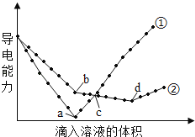
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH-
C.a、d两点对应的溶液均显中性
D.c点,两溶液中含有相同量的OH-
E.H+导电能力比Na+强
查看答案和解析>>
科目: 来源: 题型:
【题目】含硫单质的水可治皮肤病,而硫难溶于水,微溶于酒精,易溶于![]() ,要增大硫在水中的分散程度,可将硫先放入溶剂X中,再将所得液体分散在水中,则X可以是
,要增大硫在水中的分散程度,可将硫先放入溶剂X中,再将所得液体分散在水中,则X可以是
A. ![]() B. 氯仿C.
B. 氯仿C. ![]() D. 酒精
D. 酒精
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法和解释错误的是
A. 冰融化时,需破坏晶体中的全部氢键,所以冰融化时密度变大
B. 卤化物![]() 从F到I,由于分子量增大,分子间范德华力增大,熔沸点也逐渐升高
从F到I,由于分子量增大,分子间范德华力增大,熔沸点也逐渐升高
C. 由于石墨晶体中层间距较远,电子不易实现迁移,所以石墨的导电性只能沿石墨平面的方向
D. 金属中的“电子气”在电场中可以定向移动,所以金属具有良好的导电性。
查看答案和解析>>
科目: 来源: 题型:
【题目】“84消毒液”是一种以NaClO为主的高效消毒剂,被广泛用于宾馆、旅游、医院、食品加工行业、家庭等的卫生消毒。某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:


(1)此“84消毒液”的物质的量浓度约为________。(计算结果保留一位小数)
(2)某同学量取100mL此“84消毒液”,按说明要求稀释后用于消毒,则稀释后的溶液中c(Na+)=___mol/L。
(3)该同学参阅读该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为24%的消毒液。
①如图所示的仪器中配制溶液需要使用的是________________(填仪器序号),还缺少的玻璃仪器是______________。
②该同学配制此溶液需称取称量NaClO固体的质量为_________________g。
(4)若实验遇下列情况,导致所配溶液的物质的量浓度偏高的是____________(填序号)。
a.定容时俯视刻度线 b.转移前,容量瓶内有蒸馏水
c.未冷至室温就转移定容 d.定容时水多加了,用胶头滴管吸出
查看答案和解析>>
科目: 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如表:
元素代号 | X | Y | Z | W |
原子半径 | 160 | 143 | 70 | 66 |
主要化合价 |
|
|
|
|
下列叙述正确的是
A. X的电负性大于Y的电负性
B. W的氢化物比同族其它元素的氢化物稳定,是因为W的氢化物中存在氢键
C. Y的最高价氧化物对应的水化物能溶于稀硫酸和稀氨水
D. W的非金属性比Y强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com